هیئت رئیسه آکادمی علوم روسیه
جایزه گرفت
جایزه A.N.Bach 2002
آکادمیسین ایگور آناتولیویچ تارشفسکی
برای مجموعه آثار "سیستم های سیگنالینگ سلول های گیاهی"
دانشگاهیان I.A. تارشفسکی
(موسسه بیوشیمی و بیوفیزیک کازان، KSC RAS، موسسه بیوشیمی به نام A.N. Bach RAS)
سیستم های سیگنالینگ سلول های گیاهی
I.A. Tarchevsky تقریباً 40 سال است که روی تأثیر عوامل استرس زای غیر زنده و زیستی بر متابولیسم گیاهان تحقیق کرده است. در طول 12 سال گذشته، بیشترین توجه به یکی از نویدبخش ترین زمینه های بیوشیمی و فیزیولوژی گیاهی مدرن - نقش سیستم های سیگنال دهی سلولی در شکل گیری استرس، معطوف شده است. در مورد این مشکل، I.A. Tarchevsky 3 تک نگاری منتشر کرد: "کاتابولیسم و استرس در گیاهان"، "متابولیسم گیاهان تحت تنش" و "سیستم های سیگنال دهی سلول های گیاهی". در 30 مقاله، I.A. Tarchevsky و همکارانش نتایج مطالعات سیستم های سیگنالینگ آدنیلات سیکلاز، کلسیم، لیپوکسیژناز و NADPH اکسیداز را در سلول های گیاهی منتشر کردند. سیستم سیگنال دهی سنتاز NO در حال مطالعه است.
تجزیه و تحلیل ویژگی های کاتابولیسم گیاهی تحت تنش به ما امکان داد تا در مورد عملکرد سیگنالینگ "کشتی غرق شده" - محصولات الیگومری تخریب پلیمرهای زیستی و "قطعات" فسفولیپیدها نتیجه گیری کنیم. فرضیهای که در این کار در مورد ویژگیهای محرک (سیگنال) محصولات تخریب کوتین مطرح شد، بعداً توسط نویسندگان خارجی تأیید شد.
نه تنها آثار تجربی منتشر شد، بلکه مرورهایی نیز در مورد خلاصهای از نتایج مطالعات سیستمهای سیگنالینگ سلول گیاهی توسط نویسندگان داخلی و خارجی منتشر شد.
مطالعات متابولیسم لیپیدها که در آزمایشگاه نویسنده توسط A.N. Grechkin آغاز شد و سپس در آزمایشگاه مستقل او ادامه یافت، به دست آوردن نتایج اولویتی را ممکن ساخت که به طور قابل توجهی درک آبشار سیگنالینگ لیپوکسیژناز را گسترش داد. مطالعه اثر واسطه سیستم NADPH اکسیداز، اسید سالیسیلیک، بر سنتز پروتئین منجر به نتیجهگیری در مورد علت فعالیت بیولوژیکی طولانی مدت یک ترکیب دیگر، اسید سوکسینیک شد. مشخص شد که دومی یک تقلید کننده سالیسیلات است و درمان گیاهان با آن سیستم های سیگنالینگ را "روشن" می کند که منجر به سنتز پروتئین های محافظ ناشی از سالیسیلات و افزایش مقاومت در برابر عوامل بیماری زا می شود.
مشخص شد که فیتوهورمونهای استرس خارجی مختلف - اسیدهای جاسمونیک، سالیسیلیک و آبسیزیک - باعث القای سنتز پروتئینهای یکسان (که نشاندهنده «روشن شدن» مسیرهای سیگنالی یکسان توسط این هورمونها است) و پروتئینهای خاص برای هر یک از آنها (که نشان دهنده "روشن شدن" همزمان آبشارهای سیگنال مختلف است).
برای اولین بار در ادبیات جهان، I.A. Tarchevsky عملکرد همه سیستم های سیگنالینگ سلولی شناخته شده در گیاهان و احتمال تأثیر متقابل آنها را تجزیه و تحلیل کرد، که منجر به این ایده شد که در سلول ها سیستم های سیگنال دهی جدا وجود ندارد، بلکه یک شبکه سیگنالینگ متشکل از سیستم های تعاملی
طبقهبندی پروتئینهای ناشی از پاتوژن بر اساس ویژگیهای عملکردی آنها پیشنهاد شد و بررسی ویژگیهای سنتز این پروتئینها که توسط سیستمهای سیگنالینگ مختلف «روشن» شدهاند، انجام شد. برخی از آنها در سیستم های سیگنال دهی گیاهی شرکت می کنند و تشکیل شدید آنها افزایش درک، تبدیل و انتقال سیگنال های استخراج کننده به دستگاه ژنتیکی را تضمین می کند، برخی دیگر تغذیه پاتوژن ها را محدود می کنند، برخی دیگر تشکیل فیتوالکسین ها را کاتالیز می کنند، چهارم - واکنش های تقویت سلول های گیاهی. دیواره ها و دیگران باعث آپوپتوز سلول های آلوده می شوند. عملکرد همه این پروتئین های ناشی از پاتوژن به طور قابل توجهی گسترش عفونت در گیاه را محدود می کند. گروه ششم پروتئین ها می توانند مستقیماً بر ساختار و عملکرد پاتوژن ها تأثیر بگذارند و رشد آنها را متوقف یا سرکوب کنند. برخی از این پروتئینها باعث تخریب دیواره سلولی قارچها و باکتریها میشوند، برخی دیگر عملکرد غشای سلولی خود را به هم میریزند و نفوذپذیری آن را به یون تغییر میدهند و برخی دیگر عملکرد دستگاه سنتز پروتئین را سرکوب میکنند و سنتز پروتئین روی ریبوزوم قارچها را مسدود میکنند. و باکتری یا بر روی RNA ویروسی عمل می کند.
در نهایت برای اولین بار کار ساخت گیاهان تراریخته مقاوم به عوامل بیماری زا خلاصه شد و این کار مروری بر اساس طبقه بندی فوق الذکر از پروتئین های حفاظتی ناشی از بیماری زا انجام شد و توجه ویژه ای به نتایج تحقیقات شد. استفاده از گیاهان تراریخته در عملکرد سیستم های سیگنال دهی سلولی
تحقیق در مورد سیستم های سیگنال دهی سلول های گیاهی نه تنها از اهمیت نظری بالایی برخوردار است (زیرا آنها اساس مکانیسم های مولکولی استرس را تشکیل می دهند)، بلکه از اهمیت عملی زیادی نیز برخوردار است، زیرا آنها اجازه ایجاد داروهای ضد بیماری زا موثر بر اساس محرک های طبیعی و واسطه های طبیعی را می دهند. سیستم های سیگنالینگ
سخنرانی های تیمیریازف، کوستیچف و سیساکیان I.A. Tarchevsky (دومی با همکاری A.N. Grechkin)، و همچنین ارائه در کنفرانس های بین المللی (در مجارستان، انگلستان، فرانسه، لهستان، ترکیه، اسرائیل، هند، آلمان و غیره).
برای تحقیق بر روی یکی از سیستم های سیگنالینگ، لیپوکسیژناز، I.A. Tarchevsky و عضو مسئول آکادمی علوم روسیه A.N. Grechkin جایزه V.A. Engelhardt را توسط آکادمی علوم جمهوری تاتارستان در سال 1999 دریافت کردند.
در بسیاری از انتشارات I. A. Tarchevsky، همکارانش به عنوان نویسندگان مشترک شرکت کردند - عضو مسئول RAS A. N. Grechkin، دکترهای علوم زیستی F. G. Karimova، N. N. Maksyutova، V. M. Chernov، O. A. Chernova و کاندیدای علوم زیستی V.G.
در سال 2001، به ابتکار I.A. Tarchevsky و با مشارکت وی به عنوان رئیس کمیته سازماندهی، سمپوزیوم بین المللی سیستم های سیگنالینگ سلول گیاهی در مسکو برگزار شد.
ادبیات
1. Tarchevsky I.A. کاتابولیسم و تنش در گیاهان علم. M. 1993. 83 p.
2. Tarchevsky I.A. متابولیسم گیاه تحت استرس آثار برگزیده. انتشارات "فنگ" (علم). کازان 2001. 448 ص.
3. Tarchevsky I.A. سیستم های سیگنال سلول های گیاهی. M.: Nauka، 2002. 16.5 ص. (در مطبوعات).
4. Maksyutova N.N.، Viktorova L.V.، Tarchevsky I.A. تاثیر ATP و c-AMP بر سنتز پروتئین در دانه گندم. // فیزیول. بیوشیمی محصولات زراعی گیاهان 1989. T. 21. شماره 6. P.582-586.
5. گرچکین A.N.، Gafarova T.E.، Korolev O.S.، Kuramshin R.A.، Tarchevsky I.A. مسیر مونواکسیژناز اکسیداسیون اسید لینولئیک در نهال نخود فرنگی / در: نقش بیولوژیکی لیپیدهای گیاهی. بوداپست: Akad. کیادو. نیویورک، لندن. مجمع عمومی. 1368. ص83-85.
6. Tarchevsky I.A., Grechkin A.N. دیدگاه های جستجو برای آنالوگ های ایکوزانوئید در گیاهان. / در: نقش بیولوژیکی لیپیدهای گیاهی. بوداپست: Akad. کیادو. نیویورک، لندن. مجمع عمومی. 1368. ص45-49.
7. Grechkin A.N., Kukhtina N.V., Kuramshin R.A., Safonova E.Yu., Efremov Yu.Ya., Tarchevsky I.A. متابولیزاسیون اسیدهای کرونری و ورنولیک در هموژنات اپیکوتیل نخود. // Bioorgan. علم شیمی. 1990. T.16. ن 3. ص 413-418.
8. Grechkin A.N., Gafarova T.E., Tarchevsky I.A. بیوسنتز 13-oxo-9(Z)، 11(E)-tridecadienoic اسید در هموژن برگ نخود. / در: «بیوشیمی لیپید گیاهی. ساختار و استفاده». لندن. چاپ پورتلند. 1990. ص 304-306.
9. گرچکین A.N.، Kuramshin R.A.، Tarchevsky I.A. ایزومر جزئی اسید 12-oxo-10،15-phytodienoic و مکانیسم تشکیل سیکلوپنتون های طبیعی. / در: «بیوشیمی لیپید گیاهی. ساختار و استفاده». لندن. چاپ پورتلند. 1990. ص301-303.
10. Tarchevsky I.A., Kuramshin R.A., Grechkin A.N. مکالمه α-لینولنات به تریین های مزدوج و اکسوترین ها توسط لیپوکسیژناز غده سیب زمینی. / در: «بیوشیمی لیپید گیاهی. ساختار و استفاده». لندن. چاپ پورتلند. 1990. ص 298-300.
11. گرچکین A.N.، Kuramshin R.A.، Tarchevsky I.A. تشکیل α-کتول جدید توسط هیدروپراکسید دهیدراز از دانه های کتان. // Bioorgan. علم شیمی. 1991. T. 17. شماره 7. ص 997-998.
12. Grechkin A.N., Kuramshin R.A., Safonova E.Y., Yefremov Y.J., Latypov S.K., Ilyasov A.V., Tarchevsky I.A. هیدروپراکسیداسیون مضاعف اسید لینولنیک توسط لیپوکسیژناز غده سیب زمینی. //بیوشیم. بیوفیز. Acta. 1991. V. 1081. N 1. P. 79-84.
13. Tarchevsky I.A. نقش تنظیمی تجزیه بیوپلیمرها و لیپیدها. // فیزیول. گیاهان 1992. T. 39. N 6. P. 156-164.
14. Tarchevsky I.A., Maksyutova N.N., Yakovleva V.G. تأثیر اسید سالیسیلیک بر سنتز پروتئین در جوانه نخود فرنگی. // فیزیولوژی گیاهی. 1996. T.43. ن 5. ص 667-670.
15. Tarchevsky I.A.، Maksyutova N.N.، Yakovleva V.G.، Chernov V.M. پروتئین های ناشی از مایکوپلاسما و یاسمنات در گیاهان نخود // گزارش های آکادمی علوم روسیه. 1996. T. 350. N 4. P. 544 - 545.
16. Chernov V.M., Chernova O.A., Tarchevsky I.A. پدیدارشناسی عفونت های مایکوپلاسما در گیاهان. // فیزیول. گیاهان 1996. T. 43. N.5. صص 721 - 728.
17. Tarchevsky I.A. در مورد علل احتمالی اثر فعال کننده اسید سوکسینیک بر گیاهان./ در کتاب «اسید سوکسینیک در پزشکی، صنایع غذایی، کشاورزی». پوشچینو. 1376. صص 217-219.
18. گرچکین A.N., Tarchevsky I.A. سیستم سیگنالینگ لیپوکسیژناز // فیزیول. گیاهان 1999. ت 46. شماره 1. ص 132-142.
19. Karimova F.G.، Korchuganova E.E.، Tarchevsky I.A.، Abubakirova M.R. Na+/Ca+ تبادل در سلول های گیاهی. // گزارش های آکادمی علوم روسیه. 1999. T.366. شماره 6. صص 843-845.
20. Karimova F.G., Tarchevsky I.A., Mursalimova N.U., Grechkin A.N. تأثیر محصول متابولیسم لیپوکسیژناز -12-هیدروکسی دودسنوئیک اسید بر فسفوریلاسیون پروتئین های گیاهی. // فیزیول. گیاهان 1999. T.46. شماره 1. ص 148-152.
21. Tarchevsky I.A. تعامل سیستم های سیگنالینگ سلول گیاهی "روشن" شده توسط الیگوساکاریدها و سایر محرک ها. // دیدگاه های جدید در مطالعه کیتین و کیتوزان. مجموعه مقالات همایش پنجم. M. انتشارات VNIRO. 1378. صص 105-107.
22. Tarchevsky I.A., Grechkin A.N., Karimova F.G., Korchuganova E.E., Maksyutova N.N., Mukhtarova L.Sh., Yakovleva V.G., Fazliev F.N., Yagusheva M.R., Palikh E., Khokhlova L.P. در مورد امکان مشارکت سیستم های سیگنالینگ سیکلوادنیلات و لیپوکسیژناز در سازگاری گیاهان گندم با دمای پایین. / در کتاب. لبه های همکاری. به مناسبت دهمین سالگرد توافقنامه همکاری بین دانشگاه های کازان و گیسن. کازان: UNIPRESS، 1999. P.299-309.
23. Tarchevsky I.A.، Maksyutova N.N.، Yakovleva V.G.، Grechkin A.N. اسید سوکسینیک یک تقلید کننده اسید سالیسیلیک است. // فیزیول. گیاهان 1999. T. 46. شماره 1. ص 23-28.
24. گرچکین A.N., Tarchevsky I.A. آبشار سیگنالینگ لیپوکسیژناز گیاهی. // علمی تاتارستان. 2000. شماره 2. ص 28-31.
25. گرچکین A.N., Tarchevsky I.A. سیستم های سیگنالینگ سلولی و ژنوم // شیمی بیورگانیک. 2000. T. 26. شماره 10. ص 779-781.
26. Tarchevsky I.A. سیستم های سیگنال دهی القا شده توسط الایکتور و تعامل آنها // فیزیول. گیاهان 2000. ت.47.شماره 2. ص321-331.
27. Tarchevsky I.A., Chernov V.M. جنبه های مولکولی ایمنی گیاهی // قارچ شناسی و آسیب شناسی گیاهی. 2000. ت 34. شماره 3. ص 1-10.
28. Karimova F.، Kortchouganova E.، Tarchevsky I.، Lagoucheva M. انتقال گذرنده Ca+2 و Na+ در سلول های جلبکی با جهت مخالف. // پروتوپلاسما. 2000. ج 213. ص 93-98.
29. Tarchevsky I.A., Karimova F.G., Grechkin A.N. و موخامتچینا ن.م. تأثیر اسید (9Z)-12-هیدروکسی-9-دودسنوئیک و متیل جاسمونات بر فسفوریلاسیون پروتئین گیاهی. // معاملات انجمن بیوشیمی. 2000. V. 28. N. 6. P. 872-873.
30. Tarchevsky I.A. پروتئین های گیاهی ناشی از بیماری زا // میکروبیولوژی کاربردی و بیوشیمی. 2001. T. 37. شماره 5. ص 1-15.
31. Tarchevsky I.A., Maksyutova N.N., Yakovleva V.G. تاثیر سالیسیلات، جاسمونات و ABA بر سنتز پروتئین. // بیوشیمی. 2001. T. 66. N. 1. P. 87-91.
32. Yakovleva V.G.، Tarchevsky I.A.، Maksyutova N.N. تأثیر نیتروپروساید اهداکننده NO بر سنتز پروتئین در نهال نخود فرنگی // چکیده سمپوزیوم بین المللی "گیاه تحت استرس محیطی". مسکو. انتشارات دانشگاه دوستی مردم روسیه. 2001. ص 318-319.
33. Yakovleva V.G., Maksyutova N.N., Tarchevsky I.A., Abdullaeva A.R. تأثیر دهنده و بازدارنده NO- سنتاز بر سنتز پروتئین نهال نخود فرنگی. // چکیده سمپوزیوم بین المللی "سیستم های سیگنالینگ سلول های گیاهی". مسکو، روسیه، 2001، ژوئن، 5-7. ONTI، پوشچینو. 2001. ص 59.
مقاومت گیاه در برابر پاتوژن ها، همانطور که توسط H. Flor در دهه 50 قرن بیستم مشخص شد، توسط برهمکنش یک جفت ژن مکمل گیاه میزبان و عامل بیماری زا، به ترتیب، ژن مقاومت (R) و بیماری زیان آور تعیین می شود. ژن (Avr). ویژگی تعامل آنها نشان می دهد که محصولات بیان این ژن ها در شناسایی یک پاتوژن توسط گیاه با فعال شدن بعدی فرآیندهای سیگنالینگ برای فعال کردن واکنش های دفاعی نقش دارند.
در حال حاضر، 7 سیستم سیگنالینگ شناخته شده است: سیکلوادنیلات، MAP کیناز (پروتئین کیناز فعال شده با میتوژن)، اسید فسفاتیدیک، کلسیم، لیپوکسیژناز، NADPH اکسیداز (سوپراکسید سنتاز)، NO سنتاز.
در پنج سیستم سیگنال دهی اول، پروتئین های G واسطه بین بخش سیتوپلاسمی گیرنده و اولین آنزیم فعال شده هستند. این پروتئین ها در قسمت داخلی پلاسمالما قرار دارند. مولکول های آنها از سه زیر واحد a، b و g تشکیل شده است.
سیستم سیگنال دهی سیکلادنیلات برهمکنش یک عامل استرس زا با یک گیرنده بر روی پلاسمالما منجر به فعال شدن آدنیلات سیکلاز می شود که تشکیل آدنوزین مونوفسفات حلقوی (cAMP) را از ATP کاتالیز می کند. cAMP کانال های یونی از جمله سیستم سیگنال دهی کلسیم و پروتئین کینازهای وابسته به cAMP را فعال می کند. این آنزیم ها پروتئین هایی را فعال می کنند که بیان ژن های محافظ را با فسفریله کردن آنها تنظیم می کنند.
سیستم سیگنال دهی کیناز MAP. فعالیت پروتئین کینازها در گیاهان در معرض تنش (نور آبی، سرما، خشک شدن، آسیب مکانیکی، تنش شوری) و همچنین تحت درمان با اتیلن، اسید سالیسیلیک یا آلوده به یک پاتوژن افزایش مییابد.
در گیاهان، آبشار پروتئین کیناز به عنوان یک مسیر انتقال سیگنال عمل می کند. اتصال الیسیتور به گیرنده غشای پلاسمایی MAP کینازها را فعال می کند. فسفوریلاسیون MAP کیناز سیتوپلاسمی کیناز را کاتالیز می کند، که MAP کیناز را با فسفوریلاسیون مضاعف باقی مانده های ترئونین و تیروزین فعال می کند. وارد هسته می شود و در آنجا پروتئین های تنظیم کننده رونویسی را فسفریله می کند.
سیستم سیگنالینگ اسید فسفاتیدیک در سلول های حیوانی، پروتئین های G، تحت تأثیر یک عامل استرس زا، فسفولیپازهای C و D را فعال می کنند. فسفولیپاز C، فسفاتیدیل 4،5-بیس فسفات را هیدرولیز می کند و دی اسیل گلیسرول و اینوزیتول 1،4،5-تری فسفات را تشکیل می دهد. دومی Ca2+ را از حالت محدود آزاد می کند. افزایش محتوای یون های کلسیم منجر به فعال شدن پروتئین کینازهای وابسته به Ca2 + می شود. دی اسیل گلیسرول پس از فسفوریلاسیون توسط یک کیناز خاص، به اسید فسفاتیدیک تبدیل می شود که یک ماده سیگنال دهنده در سلول های حیوانی است. فسفولیپاز D به طور مستقیم تشکیل اسید فسفاتیدیک از لیپیدهای غشایی (فسفاتیدیل کولین، فسفاتیدیل اتانول آمین) را کاتالیز می کند.
در گیاهان، عوامل استرس زا باعث فعال شدن پروتئین های G، فسفولیپازهای C و D در گیاهان می شوند. بنابراین مراحل اولیه این مسیر سیگنالینگ در سلول های حیوانی و گیاهی یکسان است. می توان فرض کرد که تشکیل اسید فسفاتیدیک نیز در گیاهان رخ می دهد که می تواند پروتئین کینازها را با فسفوریلاسیون بعدی پروتئین ها از جمله عوامل تنظیم کننده رونویسی فعال کند.
سیستم سیگنالینگ کلسیم قرار گرفتن در معرض عوامل مختلف (نور قرمز، شوری، خشکسالی، سرما، شوک گرمایی، استرس اسمزی، اسید آبسیزیک، جیبرلین و عوامل بیماریزا) به دلیل افزایش واردات از سیتوپلاسم، منجر به افزایش محتوای یونهای کلسیم در سیتوپلاسم میشود. محیط خارجیو خروج از ذخایر درون سلولی (شبکه آندوپلاسمی و واکوئل)
افزایش غلظت یون های کلسیم در سیتوپلاسم منجر به فعال شدن پروتئین کینازهای محلول و وابسته به غشاء Ca2+ می شود. آنها در فسفوریلاسیون فاکتورهای پروتئینی تنظیم کننده بیان ژن های محافظ شرکت می کنند. با این حال، نشان داده شده است که Ca2 + قادر است مستقیماً بر سرکوبگر رونویسی انسان بدون دخالت آبشار فسفوریلاسیون پروتئین تأثیر بگذارد. یون های کلسیم همچنین فسفاتازها و فسفولیپاز C اختصاصی فسفوئینوزیتول را فعال می کنند. اثر تنظیمی کلسیم به تعامل آن با گیرنده کلسیم داخل سلولی - پروتئین کالمودولین - بستگی دارد.
سیستم سیگنالینگ لیپوکسیژناز برهمکنش الایسیتور با گیرنده روی پلاسمالما منجر به فعال شدن فسفولیپاز A2 متصل به غشاء می شود که آزاد شدن اسیدهای چرب غیراشباع از جمله اسیدهای لینولئیک و لینولنیک را از فسفولیپیدهای پلاسمالما کاتالیز می کند. این اسیدها سوبستراهای لیپوکسیژناز هستند. سوبستراهای این آنزیم می تواند نه تنها آزاد، بلکه اسیدهای چرب غیراشباع موجود در تری گلیسیرید باشد. فعالیت لیپوکسیژنازها تحت تأثیر الیسیتورها و عفونت گیاه با ویروس ها و قارچ ها افزایش می یابد. افزایش فعالیت لیپوکسیژناز به دلیل تحریک بیان ژن های کد کننده این آنزیم ها است.
لیپوکسیژنازها افزودن اکسیژن مولکولی به یکی از اتم های کربن (9 یا 13) رادیکال سیس، سیس-پنتادین اسیدهای چرب را کاتالیز می کنند. محصولات میانی و نهایی متابولیسم لیپوکسیژناز اسیدهای چرب دارای خواص باکتری کش و قارچ کش بوده و می توانند پروتئین کینازها را فعال کنند. بنابراین، محصولات فرار (هگزنال ها و غیرنال ها) برای میکروارگانیسم ها و قارچ ها سمی هستند، اسید 12-هیدروکسی-9Z-دودسنوئیک فسفوریلاسیون پروتئین ها را در گیاهان نخود تحریک می کند، اسید فیتودینیک، اسید جاسمونیک و متیل جاسمونات سطح بیان ژن های محافظ را افزایش می دهد. فعال سازی پروتئین کینازها
سیستم سیگنالینگ NADPH اکسیداز در بسیاری از موارد، عفونت توسط پاتوژن ها باعث تحریک تولید گونه های فعال اکسیژن و مرگ سلولی می شود. گونه های فعال اکسیژن نه تنها برای پاتوژن و سلول گیاه میزبان آلوده سمی هستند، بلکه در سیستم سیگنال دهی نیز مشارکت دارند. بنابراین، پراکسید هیدروژن فاکتورهای تنظیم کننده رونویسی و بیان ژن های محافظ را فعال می کند.
سیستم سیگنالینگ سنتاز NO در ماکروفاژهای حیوانی که باکتریها را میکشند، همراه با گونههای فعال اکسیژن، اکسید نیتریک عمل میکند و اثر ضد میکروبی آنها را افزایش میدهد. در بافت های حیوانی، ال-آرژنین با عمل NO سنتاز به سیترولین و NO تبدیل می شود. فعالیت این آنزیم در گیاهان نیز شناسایی شد و ویروس موزاییک تنباکو باعث افزایش فعالیت آن در گیاهان مقاوم شد، اما بر فعالیت NO سنتاز در گیاهان حساس تأثیری نداشت. NO، در تعامل با سوپراکسید اکسیژن، پراکسی نیتریل بسیار سمی را تشکیل می دهد. با افزایش غلظت اکسید نیتریک، گوانیلات سیکلاز فعال می شود که سنتز گوانوزین مونوفسفات حلقوی را کاتالیز می کند. پروتئین کینازها را مستقیماً یا از طریق تشکیل ADP-ribose حلقوی فعال می کند، که کانال های Ca2+ را باز می کند و در نتیجه غلظت یون های کلسیم را در سیتوپلاسم افزایش می دهد که به نوبه خود منجر به فعال شدن پروتئین کینازهای وابسته به Ca2+ می شود.
بنابراین، در سلول های گیاهی یک سیستم هماهنگ از مسیرهای سیگنال وجود دارد که می توانند مستقل از یکدیگر یا با هم عمل کنند. ویژگی خاص سیستم سیگنالینگ، تقویت سیگنال در حین انتقال آن است. فعال شدن سیستم سیگنالینگ در پاسخ به تاثیر عوامل استرس زا (از جمله عوامل بیماری زا) منجر به فعال شدن بیان ژن های محافظ و افزایش مقاومت گیاه می شود.
مکانیسم های القایی: الف) افزایش تنفس، ب) تجمع موادی که ثبات را فراهم می کنند، ج) ایجاد موانع مکانیکی محافظ اضافی، د) ایجاد واکنش حساسیت مفرط.
عامل بیماری زا با غلبه بر موانع سطحی و ورود به سیستم رسانا و سلول های گیاهی باعث بیماری گیاه می شود. ماهیت بیماری به مقاومت گیاه بستگی دارد. گیاهان از نظر میزان مقاومت به چهار دسته حساس، متحمل، فوق حساس و فوق العاده مقاوم (ایمنی) تقسیم می شوند. اجازه دهید به طور خلاصه آنها را با استفاده از مثال تعامل گیاهان با ویروس ها توصیف کنیم.
در گیاهان حساس، ویروس از سلولهای آلوده اولیه به سرتاسر گیاه منتقل میشود، به خوبی تکثیر میشود و باعث بروز علائم بیماری میشود. با این حال، حتی در گیاهان حساس مکانیسم های محافظتی وجود دارد که عفونت ویروسی را محدود می کند. برای مثال، با ازسرگیری تولید مثل ویروس موزاییک تنباکو در پروتوپلاست های جدا شده از برگ های آلوده گیاهان تنباکو، که در آن رشد عفونت زایی متوقف شده است، این امر مشهود است. مناطق سبز تیره ای که روی برگ های جوان گیاهان حساس بیمار شکل می گیرند با درجه بالایی از مقاومت در برابر ویروس ها مشخص می شوند. سلول های این مناطق در مقایسه با سلول های همسایه بافت سبز روشن تقریباً هیچ ذره ویروسی ندارند. سطح پایین تجمع ویروس در سلول های بافت سبز تیره با سنتز مواد ضد ویروسی مرتبط است. در گیاهان متحمل، ویروس در سرتاسر گیاه پخش می شود اما تولید مثل ضعیفی دارد و علائمی ایجاد نمی کند. در گیاهان بسیار حساس، سلولهای آلوده و مجاور اولیه نکروز میشوند و ویروس را در نکروز محلی میکنند. اعتقاد بر این است که در گیاهان بسیار مقاوم، ویروس فقط در سلول های آلوده اولیه تولید مثل می کند، در سراسر گیاه منتقل نمی شود و علائم بیماری ایجاد نمی کند. با این حال، انتقال آنتی ژن ویروسی و RNA های زیر ژنومی در این گیاهان نشان داده شد و زمانی که گیاهان آلوده در دمای پایین (15-10 درجه سانتیگراد) نگهداری شدند، نکروز روی برگ های آلوده ایجاد شد.
مکانیسم های مقاومت گیاهان فوق حساس به خوبی مورد مطالعه قرار گرفته است. تشکیل نکروز موضعی یک علامت معمولی از واکنش حساسیت بیش از حد گیاهان در پاسخ به آسیب پاتوژن است. آنها در نتیجه مرگ گروهی از سلول ها در محل ورود پاتوژن به وجود می آیند. مرگ سلول های آلوده و ایجاد یک سد محافظ در اطراف نکروز مانع از انتقال عوامل عفونی به سرتاسر گیاه، جلوگیری از دسترسی پاتوژن عناصر غذایی، حذف عامل بیماری زا، تشکیل آنزیم های ضد بیماری زا، متابولیت ها و مواد پیام رسان می شود. که فرآیندهای محافظتی را در سلول های همسایه و دور فعال می کند و در نهایت به بازیابی گیاه کمک می کند. مرگ سلولی به دلیل فعال شدن یک برنامه مرگ ژنتیکی و تشکیل ترکیبات و رادیکال های آزاد است که هم برای پاتوژن و هم برای خود سلول سمی هستند.
نکروزه شدن سلول های آلوده گیاهان بسیار حساس که توسط ژن های پاتوژن و گیاه میزبان کنترل می شود، یک مورد خاص از مرگ برنامه ریزی شده سلولی (PCD - مرگ برنامه ریزی شده سلولی) است. PCD برای رشد طبیعی بدن ضروری است. بنابراین، به عنوان مثال، در هنگام تمایز عناصر تراکئید در طول تشکیل آوندهای آوند چوبی و مرگ سلول های کلاهک ریشه رخ می دهد. این سلول های محیطی حتی زمانی که ریشه ها در آب رشد می کنند می میرند، به این معنی که مرگ سلولی بخشی از رشد گیاه است و ناشی از عمل خاک نیست. شباهت بین PCD و مرگ سلولی در طی یک واکنش فوق حساس این است که این دو فرآیند فعال هستند؛ در یک سلول نکروزه، محتوای یون های کلسیم در سیتوپلاسم نیز افزایش می یابد، وزیکول های غشایی تشکیل می شوند، فعالیت دئوکسی ریبونوکلئازها افزایش می یابد، DNA تجزیه می شود. قطعات با 3'OH به پایان می رسد و تراکم هسته و سیتوپلاسم رخ می دهد.
علاوه بر گنجاندن PCD، نکروز شدن سلول های آلوده گیاهان حساس در نتیجه آزاد شدن فنل ها از واکوئل مرکزی و آنزیم های هیدرولیتیک از لیزوزوم ها به دلیل نقض یکپارچگی غشای سلولی و افزایش نفوذپذیری آنها رخ می دهد. کاهش یکپارچگی غشای سلولی ناشی از پراکسیداسیون لیپیدی است. این می تواند با مشارکت آنزیم ها و به صورت غیر آنزیمی در نتیجه عملکرد گونه های فعال اکسیژن و رادیکال های آلی آزاد رخ دهد.
یکی از خصوصیات بارز گیاهان حساس، مقاومت اکتسابی (القا شده) در برابر عفونت مکرر توسط پاتوژن است. اصطلاحات مقاومت اکتسابی سیستمیک (SAR) و مقاومت اکتسابی موضعی (LAR) پیشنهاد شدند. گفته می شود که LAR زمانی رخ می دهد که سلول ها در ناحیه بلافاصله مجاور نکروز موضعی (فاصله تقریباً 2 میلی متر) مقاومت پیدا کنند. در این حالت نکروز ثانویه به هیچ وجه تشکیل نمی شود. مقاومت اکتسابی در صورتی که در سلول های گیاه بیمار که از محل معرفی اولیه پاتوژن دور هستند ایجاد شود سیستمیک در نظر گرفته می شود. SAR خود را در کاهش سطح تجمع ویروس در سلول ها و کاهش اندازه نکروز ثانویه نشان می دهد که نشان دهنده مهار انتقال ویروس با برد کوتاه است. مشخص نیست که آیا LAR و SAR با یکدیگر متفاوت هستند یا اینکه آیا آنها همان فرآیندی هستند که در سلول هایی که در فواصل مختلف از محل ورود اولیه ویروس به گیاه قرار دارند اتفاق می افتد.
مقاومت اکتسابی معمولاً غیر اختصاصی است. مقاومت گیاه در برابر ویروس ها ناشی از عفونت های باکتریایی و قارچی بود و بالعکس. مقاومت می تواند نه تنها توسط پاتوژن ها، بلکه توسط مواد مختلف ایجاد شود.
توسعه SAR با انتشار مواد تشکیلشده در برگهای آلوده اولیه در گیاه همراه است. فرض بر این بود که القاء کننده SAR سالیسیلیک اسید است که در طی نکروز سلولهای آلوده اولیه تشکیل میشود.
هنگامی که گیاهان بیمار می شوند، موادی در گیاهان جمع می شوند که مقاومت آنها را در برابر عوامل بیماری زا افزایش می دهد. مواد آنتی بیوتیکی، فیتونسیدها که توسط B. Tokin در دهه 20 قرن بیستم کشف شد، نقش مهمی در مقاومت غیراختصاصی گیاه دارند. اینها شامل مواد با وزن مولکولی کم با ساختارهای مختلف (ترکیبات آلیفاتیک، کینون ها، گلیکوزیدها با فنل ها، الکل ها) هستند که می توانند رشد را به تاخیر بیندازند یا میکروارگانیسم ها را از بین ببرند. فیتونسیدهای فرار که زمانی که پیاز و سیر زخمی می شوند آزاد می شوند، گیاه را از عوامل بیماری زا در بالای سطح اندام ها محافظت می کنند. فیتونسیدهای غیرفرار در بافت های پوششی موضعی می شوند و در ایجاد خواص محافظتی سطح شرکت می کنند. در داخل سلول ها می توانند در واکوئل ها تجمع کنند. هنگامی که آسیب می بیند، مقدار فیتونسیدها به شدت افزایش می یابد، که از عفونت احتمالی بافت های زخمی جلوگیری می کند.
فنل ها نیز به عنوان مواد آنتی بیوتیکی در گیاهان طبقه بندی می شوند. در صورت آسیب و بیماری، پلی فنل اکسیداز در سلول ها فعال می شود که باعث اکسید شدن فنل ها به کینون های بسیار سمی می شود. ترکیبات فنلی پاتوژن ها و سلول های گیاه میزبان را از بین می برند، اگزونزیم های پاتوژن را غیرفعال می کنند و برای سنتز لیگنین ضروری هستند.
پروتئین ها، گلیکوپروتئین ها، پلی ساکاریدها، RNA و ترکیبات فنلی در میان مهارکننده های ویروسی یافت شدند. مهارکننده های عفونت وجود دارند که مستقیماً بر ذرات ویروسی تأثیر می گذارند و آنها را غیرعفونی می کنند یا گیرنده های ویروسی را مسدود می کنند. به عنوان مثال، مهارکنندههای آب چغندر، جعفری و توت باعث تخریب تقریباً کامل ذرات ویروس موزاییک تنباکو میشوند و آب آلوئه باعث تجمع خطی ذرات میشود که احتمال نفوذ ذرات به داخل سلولها را کاهش میدهد. مهارکننده های تولید مثل متابولیسم سلولی را تغییر می دهند و در نتیجه ثبات سلولی را افزایش می دهند یا تولید مثل ویروسی را مهار می کنند. پروتئین های غیرفعال کننده ریبوزوم (RIPs) در مقاومت گیاه در برابر ویروس ها نقش دارند.
در گیاهان تنباکوی بسیار حساس آلوده به ویروس موزاییک تنباکو، پروتئینهایی که ابتدا پروتئینهای b نامیده میشوند و اکنون به عنوان پروتئینهای مرتبط با بیماریزایی (PR-proteins) یا پروتئینهای مرتبط با مقاومت شناخته میشوند، کشف شد. نام رایج "پروتئین های PR" نشان می دهد که سنتز آنها فقط توسط پاتوژن ها ایجاد می شود. با این حال، این پروتئین ها در گیاهان سالم در هنگام گلدهی و شرایط مختلف استرس نیز تشکیل می شوند.
در سال 1999، بر اساس توالی اسید آمینه، خواص سرولوژیکی، آنزیم و فعالیت بیولوژیکی، یک نامگذاری یکپارچه از پروتئین های PR برای همه گیاهان، متشکل از 14 خانواده (PR-1 - PR-14) ایجاد شد. برخی از پروتئین های PR دارای فعالیت های پروتئاز، ریبونوکلئاز، 1،3-b-گلوکاناز، کیتیناز یا مهارکننده های پروتئاز هستند. گیاهان عالی کیتین ندارند. احتمالاً این پروتئینها در دفاع گیاه در برابر قارچها نقش دارند، زیرا کیتین و b-1,3-glucans اجزای اصلی دیواره سلولی بسیاری از قارچها هستند و کیتیناز پیوندهای b-1,3 کیتین را هیدرولیز میکند. کیتیناز همچنین می تواند مانند لیزوزیم عمل کند و پپتیدوگلوکان ها را در دیواره سلولی باکتری هیدرولیز کند. با این حال، b-1،3-گلوکاناز ممکن است انتقال ذرات ویروس را در طول برگ تسهیل کند. این با این واقعیت توضیح داده می شود که b-1,3-glucanase باعث تخریب کالوز (b-1,3-glucan) می شود که در دیواره سلولی و پلاسمودسماتا رسوب می کند و انتقال ویروس را مسدود می کند.
پروتئینهای PR همچنین شامل پروتئینهایی با وزن مولکولی کم (5 کیلو دالتون) هستند - اصلاحکنندههای غشای سلولی قارچها و باکتریها: تیونینها، دیفنسینها و پروتئینهای انتقال چربی. تیونین ها در شرایط آزمایشگاهی برای قارچ ها و باکتری های بیماریزای گیاهی سمی هستند. سمیت آنها به دلیل اثر مخرب آنها بر غشای عوامل بیماری زا است. دیفنسین ها دارای خواص ضد قارچی قوی هستند، اما هیچ تاثیری روی باکتری ها ندارند. دفاع از گیاهان خانواده Brassicaceae و Saxifragaceae رشد طویل شدن هیف های قارچی را سرکوب کردند اما شاخه های آنها را تقویت کردند. دفاع از گیاهان خانواده های Asteraceae، Fabaceae و Hippocastanaceae باعث کاهش طول هیف ها می شود، اما مورفولوژی آنها را تحت تاثیر قرار نمی دهد.
هنگامی که گیاهان به عوامل بیماری زا آلوده می شوند، فعالیت بخش لیتیک سلول های گیاهان حساس و فوق حساس افزایش می یابد. محفظه لیتیک سلول های گیاهی شامل واکوئل های کوچک - مشتقات شبکه آندوپلاسمی و دستگاه گلژی است که به عنوان لیزوزوم های اولیه حیوانات عمل می کنند، یعنی ساختارهای حاوی هیدرولاز که در آن هیچ بستری برای این آنزیم ها وجود ندارد. علاوه بر این واکوئلها، محفظه لیتیک سلولهای گیاهی شامل یک واکوئل مرکزی و واکوئلهای دیگر، معادل لیزوزومهای ثانویه سلولهای جانوری است که حاوی هیدرولازها و زیرلایههای آنها و همچنین پلاسمالما و مشتقات آن از جمله اجسام پارامورال و هیدرولازهای خارج سلولی است. در دیواره سلولی و در فضای بین دیواره و پلاسمالما قرار دارد.
AB11 و AB12 نقش کلیدی در القای ABA دارند
مسیر سیگنال حمام فعال سازی وابسته به pH و Mg2 + وابسته مشاهده شد.
vation ABU.
هدف اصلی پروتئین فسفاتازهای MP2C MAPKKK است که تحت تأثیر عوامل استرس زای مختلف فعال می شود. اگر در نظر بگیریم که برخی از پروتئین فسفاتازها دارای محل اتصال با پروتئین کینازهای مربوطه خود هستند، این ویژگی قابل درک می شود.
سیگنال دهی به شرکت کنندگان
سیستم های سلول ملی این امر امکان اطمینان از وجود کمپلکس پروتئین کیناز- پروتئین فسفاتاز را فراهم می کند و به موقع و به طور موثر از تبدیل و انتقال یک سیگنال سیگنال به ژنوم جلوگیری می کند. اصل عملکرد این مکانیسم بسیار ساده است: تجمع یک پروتئین کیناز خاص - یک واسطه از زنجیره سیگنال - فسفوپروتئین فسفاتاز را فعال می کند و منجر به دفسفوریلاسیون (غیرفعال) پروتئین کیناز می شود. به عنوان مثال، فعال شدن پروتئین کینازهای خاص می تواند منجر به فسفوریلاسیون و فعال شدن پروتئین فسفاتازهای مربوطه شود. هنگام مطالعه عملکرد پروتئین فسفاتازها، اغلب از مهارکننده های خاص استفاده می شود، به عنوان مثال اسید اوکادائیک و کالیکولین.
عوامل تنظیم رونویسی
سنتز RNA های پیام رسان توسط RNA پلیمرازهای وابسته به DNA کاتالیز می شود که یکی از بزرگترین کمپلکس های پروتئینی شامل دو زیر واحد بزرگ و 5-13 زیر واحد کوچک است که با پیچیدگی و اهمیت عملکرد آنها مشخص می شود.این زیر واحدها دارای محافظه کاری هستند. توالیهای آمینواسید، عمدتاً یا به میزان کمتری در حیوانات و گیاهان مشترک هستند، فعالیت iRNA پلیمراز و شناسایی ژنهای رونویسی شده توسط چندین نوع پروتئین تنظیم میشود. عوامل تنظیمکننده رونویسی بیشترین توجه را به خود جلب کردهاند. این پروتئینها میتوانند با پروتئینهای دیگر، از جمله پروتئینهای یکسان، تعامل داشته باشند، هنگام فسفریله کردن چندین اسید آمینه تشکیلدهندهشان، ساختارشان را تغییر دهند، [توالیهای تنظیمی نوکلئوتیدها را در نواحی پروموتر ژنها تشخیص دهند، که منجر به تغییر در شدت بیان آنها میشود. : این عوامل تنظیم کننده رونویسی هستند که RNA-پلیمراز را به نقطه شروع رونویسی ژن مربوطه (یا مجموعه ای از ژن ها) هدایت می کنند، بدون اینکه مستقیماً در عمل کاتالیزوری سنتز mRNA شرکت کنند.
در موجودات جانوری، ویژگی های ساختاری بیش از 1000 عامل تنظیم رونویسی مشخص شده است. شبیه سازی ژن های آنها به دستیابی به اطلاعاتی کمک کرد که امکان طبقه بندی این پروتئین ها را فراهم کرد.
همه عوامل تنظیم کننده رونویسی شامل سه حوزه اصلی هستند. حفاظت شده ترین دامنه اتصال به DNA است. توالی اسیدهای آمینه موجود در آن تشخیص توالی نوکلئوتیدی خاصی را در پروموترهای ژن تعیین می کند.
بسته به همسانی ساختارهای اولیه و ثانویه دامنه اتصال به DNA، عوامل تنظیم کننده رونویسی به چهار ابر کلاس تقسیم می شوند: 1) با دامنه های غنی شده با اسیدهای آمینه اساسی. 2) با دامنه های اتصال به DNA که یون های روی را هماهنگ می کند - "انگشتان روی"؛ 3) با دامنه هایی از نوع helix-turn-helix. 4) با دامنه هایی از نوع | 3-داربست، که تماس هایی را با شیار جزئی DNA ایجاد می کند [پاتروشف، 2000]. هر ابر کلاس به کلاس ها، خانواده ها و زیر خانواده ها تقسیم می شود. قابل توجه در سوپرکلاس 1 عوامل تنظیم کننده رونویسی با دامنه های زیپ لوسین هستند که os-helices هستند که در آن هر هفتمین اسید آمینه لوسینی است که از یک طرف مارپیچ بیرون زده است. برهمکنش آبگریز باقیماندههای لوسین یک مولکول با مارپیچ مشابه مولکول دیگر، دیمریزاسیون (بر اساس قیاس با زیپ) فاکتورهای تنظیمکننده رونویسی لازم برای برهمکنش با DNA را فراهم میکند.
در سوپرکلاس 2، انگشت روی توالی اسید آمینه حاوی چهار باقیمانده سیستئین است که اثر هماهنگی بر روی یون روی دارد. انگشتان روی با شیار اصلی DNA تعامل دارند. در کلاس دیگری از این ابر کلاس، ساختار «انگشت روی» توسط دو باقیمانده سیستئین و دو باقیمانده هیستیدین ارائه میشود (شکل 5)؛ در کلاس دیگر، هماهنگی دو یون روی در یک «انگشت» انجام میشود. توسط شش باقیمانده سیستئین. نوک انگشتان روی با شیار اصلی DNA تماس دارد.
مطالعه ساختار عوامل تنظیم کننده رونویسی در گیاهان امکان ایجاد همسانی با پروتئین هایی از این نوع، مشخصه اشیاء حیوانی را فراهم کرد. فاکتورهای تنظیمی رونویسی معمولی شامل سه عنصر ساختاری اصلی زیر است: پیوند DNA، الیگومریزاسیون و حوزه های تنظیمی. اشکال مونومر فاکتورهای رونویسی بر خلاف اشکال دیمری (الیگومریک) غیرفعال هستند. تشکیل اشکال الیگومری با فسفوریلاسیون اشکال مونومر در سیتوزول انجام می شود، سپس پیوند آنها اتفاق می افتد و سپس تحویل به هسته یا با استفاده از
برنج. 5. ساختار فاکتور تنظیمی رونویسی "انگشت روی".
G - باقی مانده هیستیدین؛ C-S - باقی مانده سیستئین
پروتئین های انتقال ویژه یا به دلیل تعامل با پروتئین های گیرنده در منافذ غشای هسته ای، پس از آن به هسته منتقل می شوند و با نواحی پروموتر تعامل می کنند.
ژن های مربوطه فاکتورهای تنظیمکننده رونویسی توسط خانوادههای چند ژنی کدگذاری میشوند و سنتز آنها میتواند توسط پاتوژنها و محرکها القا شود و فعالیت آنها در نتیجه تغییرات پس از ترجمه (عمدتاً فسفوریلاسیون یا دفسفوریلاسیون) تغییر یابد.
در حال حاضر، یک پایگاه داده در حال گسترش در مورد ساختار عوامل تنظیم کننده رونویسی مختلف و ژن های آنها در گیاهان ایجاد شده است. نشان داده شده است که ویژگی اتصال DNA توسط توالی اسید آمینه نواحی ساقه و حلقه در زیپهای لوسینی که قبلاً ذکر شد تعیین میشود، که یکی از گروههای متعدد و حفاظتشده فاکتورهای تنظیمکننده رونویسی یوکاریوتی را نشان میدهد. عوامل تنظیمکننده رونویسی اغلب بر اساس ساختار حوزههای اتصال به DNA طبقهبندی میشوند که ممکن است شامل توالیهای اسید آمینه مارپیچ، "انگشتان روی" باشد - مناطقی با دو سیستئین و دو باقی مانده هیستیدین یا با بسیاری از باقی ماندههای سیستئین و غیره. در گیاهان، یک تا چهار "انگشت روی" در حوزه های اتصال به DNA عوامل تنظیم کننده رونویسی یافت می شود.
مکانیسم تعامل عوامل تنظیم کننده رونویسی با RNA پلیمرازهای وابسته به DNA و نواحی پروموتر ژن یکی از مشکلات کلیدی و هنوز به اندازه کافی مطالعه نشده در عملکرد ژنوم سلول باقی مانده است. اطلاعات مربوط به اشیاء گیاهی به ویژه کمیاب است.
جهش در ژنهای کدکننده فاکتورهای تنظیمکننده رونویسی در حیوانات میتواند منجر به بیماریهای خاصی شود.
اعضای خانوادهای از ژنهای کدکننده فاکتورهای تنظیمکننده رونویسی زیپ لوسین در گیاهان توصیف شدهاند. نشان داده شده است که فاکتورهای رونویسی از این نوع مسئول تشکیل پروتئین های ضد بیماری زا توسط سالیسیلات هستند و جهش در این ژن ها منجر به از دست دادن توانایی سنتز این پروتئین ها می شود.
پروموتر ژن ها برای سیستم های سیگنالینگ پروتئین ها و پروتئین های محافظ
در حال حاضر، ساختار نواحی پروموتور ژنهایی که مسئول به دست آوردن ایمنی در برابر پاتوژنهای مختلف هستند، به شدت در حال مطالعه است. واقعیت سنتز تقریباً همزمان تعدادی از پروتئینهای القایی با پاتوژن مدتهاست که توجه را به خود جلب کرده است: این امر میتواند ناشی از واگرایی مسیرهای سیگنالینگ در یک سیستم سیگنالینگ باشد که باعث فعال شدن چندین نوع از عوامل تنظیمکننده رونویسی میشود یا توسط "روشن شدن" چندین سیستم سیگنال دهی توسط یک یا آن السیتور، که با عملکرد موازی، چندین نوع فاکتور تنظیم کننده رونویسی را فعال می کنند و در نتیجه بیان چندین نوع پروتئین محافظ را القا می کنند. همچنین ممکن است که پروموترهای ژنی چندین پروتئین منفرد ساختار عناصر تنظیمی یکسانی داشته باشند، که منجر به بیان همزمان آنها حتی در صورت فعال شدن سیگنال یک نماینده از عوامل تنظیم کننده رونویسی می شود.
گزینه دوم زمانی اتفاق میافتد که گیاهان در معرض استرس فیتوهورمون اتیلن قرار میگیرند، زمانی که فاکتور تنظیمکننده رونویسی با جعبه GCC نواحی پروموتور چندین ژن القایی با اتیلن تعامل میکند، که تشکیل کم و بیش همزمان یک گروه کامل از اتیلن را تضمین میکند. پروتئین ها این اصل سنتز دسته ای پروتئین های محافظ زمانی اجرا می شود که سلول ها به عوامل استرس زا یا تحریک کننده های مختلف پاسخ می دهند (فیتوهورمون های استرس را می توان به عنوان تحریک کننده های ثانویه نیز طبقه بندی کرد). به عنوان مثال، تحت تأثیر دماهای بالا، رونویسی گروهی از ژنها که حاوی یک تنظیم مشترک در نواحی پروموتر آنها هستند، القا میشود.
عنصر tor HSE (عنصر شوک حرارتی)، در سایر ژن ها وجود ندارد. این الگو با استفاده از تکنیک ایجاد ژنهای ترکیبی با پروموتر ژن شوک حرارتی همراه با ژن دیگری که معمولاً شدت بیان را در مواجهه با دماهای بالا تغییر نمیدهد تأیید شد. در مورد گیاهان تراریخته، بیان آن آغاز شد. در سلولهای یوکاریوتی، نواحی پروموتر با توالیهای نوکلئوتیدی مشابه نیز در ژنهای مختلف القا شده توسط همان واسطه (پیامرسان دوم) سیستمهای سیگنالینگ، به عنوان مثال، AMP حلقوی یافت میشوند. در مورد دوم، دنباله سیگنال نوکلئوتیدهای ناحیه پروموتر CRE (عنصر پاسخ AMP حلقوی) تعیین می شود.
در آرابیدوپسیس، یک سیستم گلوکوکورتیکوئیدی برای فعالسازی فاکتورهای تنظیمکننده رونویسی کشف شد که گنجاندن آن منجر به بیان ژنهای محافظ ناشی از پاتوژن شد [N. کانگ و همکاران، 1999]. توالی های نوکلئوتیدی رایج در G-box pro-
موتورها CCACGTGG بودند و در جعبه C - TGACGTCA.
ویروس موزاییک تنباکو و اسید سالیسیلیک باعث القای دو ژن از فاکتورهای تنظیم کننده رونویسی کلاس WRKY در گیاهان تنباکو شدند و یک توالی نوکلئوتیدی خاص را در مناطق پروموتور ژن های محافظ - TTGAC (W-box) تشخیص دادند. فعال سازی این عوامل تنظیم کننده رونویسی از طریق فسفوریلاسیون آنها توسط پروتئین کینازها انجام شد. همه پروتئینهای کلاس WRKY، برخلاف سایر کلاسهای فاکتورهای رونویسی (مانند bZIP و myb)، دارای یک دامنه حفاظتشده حاوی آنزیم هپتامر هستند.
شناسه WRKYGQK .
(یکی از حوزههای عامل تنظیمکننده رونویسی که مسئول تبدیل سیگنال جاسمونات است، ناحیه تنظیمکننده پروموتر چندین ژن را فعال میکند که پروتئینهای القای جاسمونات و القاکنندهها، بهویژه استریگوزیدین سنتاز را کد میکنند. مشخص شد که ترمینال N دامنه اسیدی فاکتور تنظیمکننده رونویسی اثر فعالکننده دارد و دامنه C ترمینال -I غنیشده با باقیماندههای سرین، مهارکننده است.
نشان داده شده است که پروموتر ژن فنیل آلانین آمونیاک لیاز (مهمترین آنزیم شروع فرآیند متابولیک شاخه ای سنتز ترکیباتی که نقش محافظتی ایفا می کنند - سالیسیلات، اسیدهای فنولیک، فیتوآلکسین های فنیل پروپانوئید و لیگنین) حاوی دو نسخه از مناطق غنی شده است. با تکرارهای AC
هنگام مطالعه پروموتر ژن برای آنزیم دیگر سنتز کننده فیتوالکسین ها - کالکون سنتاز، در کشت سلولی لوبیا، تنباکو و برنج، مشخص شد که G-box (CACGTG) در منطقه از 74- تا 69- جفت نوکلئوتیدی و H -جعبهها (CCTAC) در فعالسازی پروموتر در ناحیه از 61- تا 56- و از 126- تا 121- جفت نوکلئوتیدی شرکت میکنند.
در آزمایشهای دیگر، مشخص شد که تحت تأثیر الیسیتورها، بیان ژن کالکون سنتاز در گیاهان نخود به ناحیه پروموتر از 242- تا 182- جفت نوکلئوتیدی بستگی دارد که در آن دو ناحیه حاوی توالیهای AT یکسان -TAAAAATAST- هستند. که یکی از آنها در منطقه 242- تا 226- قرار داشت، برای بیان حداکثر فعالیت ژن ضروری بود.
پروموتر ژن سنتاز سنتاز، یکی از آنزیمهای کلیدی القاکننده القاکننده در سنتز فیتوالکسینهای ترپنوئیدی، دارای ناحیهای است که توسط عوامل تنظیمکننده رونویسی از 339- تا 145- جفت نوکلئوتیدی فعال میشود. G-box واقع در نزدیکی جفت نوکلئوتید -105 بر فعالیت پروموتر تأثیری نداشت.
هنگام مطالعه فعالیت ژن |3-1،3-گلوکاناز در گیاهان تنباکو، مشخص شد که این ژن به ناحیه پروموتر از 250- تا 217- جفت نوکلئوتیدی بستگی دارد که حاوی توالی -GGCGGC- است که مشخصه پروموترها است. ژن های کد کننده قلیایی القایی با پاتوژن
پروتئین های ny
به اصطلاح PR-box نواحی پروموتر بسیاری از پروتئین های القایی پاتوژن حاوی یک توالی (5"-AGCCGCC-3") است که فاکتورهای تنظیم کننده رونویسی مربوطه به آن متصل می شوند که منجر به بیان ژن های این پروتئین ها می شود. به ویژه اندوکیتینازها و P-1،3-گلوکانازها در گیاهان گوجه فرنگی.
بسیاری از ژنهای پروتئینهای قابل القای پاتوژن حاوی عناصر بهاصطلاح ocs در پروموترهای خود هستند که فاکتورهای تنظیمکننده رونویسی که دارای زیپهای لوسین در ساختار خود هستند، با آنها تعامل دارند. در گیاهان آرابیدوپسیس، فاکتورهای تنظیمکننده رونویسی که مسئول انتقال سیگنال اتیلن هستند به جعبه GCC و عناصر ocs پروموتورها متصل میشوند که منجر به بیان تعدادی از پروتئینهای محافظ میشود.
مطالعه گیاهان تنباکوی تراریخته با یک پروموتر کیتیناز قلیایی و یک ژن گزارشگر GUS نشان داد که ناحیه پروموتر فعال شده توسط سیگنال اتیلن بین 503- و 358- جفت نوکلئوتید قرار دارد، جایی که دو نسخه از جعبه GCC وجود دارد (5 اینچ - TAAGAGCCGCC-3")، که مشخص می شود -
ren برای پروموترهای بسیاری از پروتئین های القایی با اتیلن. تجزیه و تحلیل بیشتر نشان داد که ناحیه پروموتر مسئول پاسخ به اتیلن با دو نسخه از جعبه GCC بین 480- و 410- جفت نوکلئوتیدی قرار دارد.
هنگام مطالعه پاسخ گیاهان تنباکو به تیمار با اتیلن و عفونت با ویروس موزاییک، مشخص شد که فعالیت پروموتر ژن (3-1،3-گلوکاناز) به ناحیه ای بستگی دارد که بین 1452- و 1193- جفت نوکلئوتیدی قرار دارد. که در آن دو نسخه از هپتانوکلئوتید وجود دارد
5-AGCCGCC-3. یافت و اضافی
نواحی ضروری برای تنظیم فعالیت پروموتور.
الایسیتورها، گیرنده های الایسیتور، پروتئین های G، پروتئین کینازها، پروتئین فسفاتازها، فاکتورهای تنظیم کننده رونویسی و نواحی پروموتور ژن مربوطه آنها که در بالا مورد بحث قرار گرفت در عملکرد تعدادی از سیستم های سیگنال دهی سلولی شرکت می کنند که بر اساس آنها پاسخ آنها به سیگنال های ماهیت متفاوت است. و شدت بستگی دارد: آدنیلات سیکلاز، MAP- کیناز، فسفاتیدات، کلسیم، لیپوکسیژناز، NADPH اکسیداز، NO سنتاز و پروتون.
سیستم سیگنال دهی سیکلاز آدنیلات
این سیستم سیگنالینگ نام خود را از آنزیم آدنیلات سیکلاز گرفته است که برای اولین بار توسط ساترلند مشخص شد که تشکیل واسطه سیگنالینگ اصلی این سیستم - آدنوزین مونوفسفات حلقوی (cAMP) را کاتالیز می کند. طرح سیستم آدنیلات سیکلاز به شرح زیر است: یک سیگنال شیمیایی خارجی، به عنوان مثال یک هورمون یا السیتور، با گیرنده پروتئینی پلاسمالما تعامل می کند، که منجر به فعال شدن پروتئین G (اتصال GTP) و انتقال آن می شود. یک سیگنال سیگنال به آنزیم آدنیلات سیکلاز (AC)، که سنتز cAMP از ATP را کاتالیز می کند (شکل 6).
در سیستم آدنیلات سیکلاز، بین پروتئینهای Gs که آدنیلات سیکلاز را تحریک میکنند و (5، پروتئینهایی که فعالیت آنزیم را مهار میکنند، تفاوت قائل میشود. تفاوت بین این دو نوع پروتئین عمدتاً با ویژگیهای oc مشخص میشود. زیرواحدها، و نه زیر واحدهای 3 و y. توده مولکولی ocs - زیر واحدهای پروتئین G 41-46 کیلو دالتون، زیر واحدهای ag - 40-41 کیلو دالتون، (3، - و P2 - زیرواحدهای - 36-35 کیلو دالتون، زیرواحدهای y هستند. - 8-10 کیلو دالتون اتصال G-پروتئین GTP و هیدرولیز آن به GDP و ارتوفسفات معدنی برگشت پذیری فرآیندهای فعال سازی آدنیلات سیکلاز را تضمین می کند.
آدنیلات سیکلاز یک پروتئین انتگرال مونومری غشای پلاسما است و بنابراین استخراج و تبدیل آن به شکل محلول دشوار است. وزن مولکولی آدنیلات سیکلاز در سلول های حیوانی 120-155 کیلو دالتون است. همچنین اشکال محلول آدنیلات سیکلاز 50-70 کیلو دالتون، غیر حساس به کالمودولین و پروتئین های G وجود دارد. در گیاهان، وزن مولکولی آدنیلات سیکلاز 84 کیلو دالتون است. منحنی وابستگی فعالیت آدنیلات سیکلاز به pH دارای ویژگی یک پیک و پیک فعالیت برای این آنزیم بود.

PH در محدوده 4.8-5.2 بود.
داده ها بر روی ایزوفرم آدنیلات سیکلاز با بهینه به دست آمد
pH مادر برابر با 8.8 است.
آدنیلات سیکلاز را می توان در قسمت بیرونی غشاء توسط گلیکوزیلاسیون و در داخل توسط فسفوریلاسیون توسط A-kinase اصلاح کرد [Severin, 1991]. فعالیت آدنیلات سیکلاز غشایی به محیط فسفولیپید بستگی دارد - نسبت فسفاتیدیل کولین، فسفاتیدیل-اتانول آمین، اسفنگومیلین، فسفاتیدیل ها"اری-
روی و فسفاتیدیلینوزیتول.
افزایش محتوی cAMP در سلول ها گذرا است که با فعال شدن PDE و احتمالاً اتصال توسط پروتئین کینازهای وابسته به cAMP توضیح داده می شود. در واقع، افزایش غلظت cAMP در سلول ها، پروتئین کینازهای مختلف وابسته به cAMP را فعال می کند، که می تواند پروتئین های مختلف، از جمله عوامل تنظیم کننده رونویسی را فسفریله کند، که منجر به بیان ژن های مختلف و پاسخ سلول به تأثیرات خارجی می شود.
فاکتور ضرب سیگنال به دست آمده در طول انتقال آن به ژنوم و بیان ژن هزاران است. طرح ضرب سیگنال برای عملکرد سیستم سیگنال دهی آدنیلات سیکلاز اغلب در کتاب های درسی بیوشیمی استفاده می شود. این سیستم سیگنالینگ به طور فشرده بر روی اشیاء مختلف مورد مطالعه قرار می گیرد و درک حوزه اطلاعات سلول ها و ارتباط آن با جریان های اطلاعات خارجی را گسترش می دهد.
لازم به ذکر است که مسئله عملکرد سیستم سیگنالینگ آدنیلات سیکلاز در اجسام گیاهی تقریباً برای یک ربع قرن بحث برانگیز باقی ماند و محققان را به دو دسته تقسیم کرد.
بیان ژن
برنج. 6. طرح عملکرد سیگنالینگ آدنیلات سیکلاز
سیستم های AC* - شکل فعال آدنیلات سیکلاز. PKA و PKA* - غیر فعال -
اشکال فعال و فعال پروتئین کیناز A؛ پلاسمالما PL; PDE - فسفودی استراز؛ PRT* - شکل فعال عامل تنظیم کننده رونویسی
حامیان [دومان، فدنکو، 1976; کورولف، ویسکربنتسوا، 1978؛ فرانکو، 1983; یاورسکایا، کالینین، 1984; نیوتن و براون، 1986; کریموا، 1994، آسمان، 1995; ترواواس و مالهو، 1997; Trewavas، 1999; و غیره] و مخالفان. اولی متکی به دادههای مربوط به افزایش فعالیت آدنیلات سیکلاز و محتوای cAMP تحت تأثیر هورمونهای گیاهی و پاتوژنها، بر تقلید از عملکرد هورمونهای گیاهی مختلف توسط cAMP برونزا، دوم - بر حقایقی که نشاندهنده محتوای ناچیز است. cAMP در گیاهان، در مورد عدم وجود در تعدادی از آزمایشات تأثیر فیتوهورمون ها بر فعالیت آدنیلات سیکلاز و غیره.
پیشرفتها در زمینه ژنتیک مولکولی و مقایسه ساختار ژنی پروتئینهای شرکتکننده در سیستم سیگنالدهی آدنیلات سیکلاز در جانوران و گیاهان، ترازو را به نفع حامیان عملکرد آن در گیاهان تغییر داده است. نتیجه-
استفاده از cAMP اگزوژن [Kilev، Chekurov، 1977] یا فورسکولین (فعال کننده آدنیلات سیکلاز) مشارکت cAMP را در زنجیره انتقال سیگنال ناشی از سیگنال نشان داد. استفاده از تئوفیلین، یک مهارکننده cAMP فسفودی استراز، که معلوم شد در گیاهان کاملاً فعال است، نشان داد که بخش ورودی تعادل cAMP به شدت انجام می شود [Yavorskaya, 1990; کریموا و همکاران، 1990]. داده ها در مورد تغییرات در محتوای cAMP در گیاهان تحت تأثیر عوامل بیماری زا، ضرورت آن برای تشکیل پاسخ به عمل پاتوژن ها به دست آمد [Zarubina et al., 1979; Ocheretina و همکاران، 1990].
نکته قابل توجه انتشار وابسته به ATP در محیط خارج سلولی بخش قابل توجهی از cAMP است که در سلول های حیوانات، پروکاریوت ها، جلبک ها و نژادهای بالاتر تشکیل شده است.
سایه ها توسط-
قابل توجه است که در گیاهان، و همچنین در حیوانات، کاهش تجمع cAMP در سلول ها و انتشار آن در محیط خارج سلولی با کمک پروستاگلاندین، که در گیاهان یافت نمی شود، ممکن شد. ممکن است
اما این نقش توسط یک اکسی لیپین پروستاگلاندین مانند - جاسمونات انجام می شود. فرض بر این است که پروتئینهای خاص متصل شونده به ATP در حذف cAMP از سلول نقش دارند.
پروتئین ها
مصلحت ترشح cAMP از سلول های گیاهی به محیط، اول از همه، با نیاز به کاهش سریع غلظت این پیام رسان ثانویه به طوری که تحریک بیش از حد سلول ها رخ ندهد، توضیح داده می شود. کاهش نسبتاً سریع غلظت پیامرسانهای ثانویه پس از رسیدن به حداکثر سطح یک ویژگی غیراختصاصی ضروری در عملکرد همه سیستمهای سیگنالینگ است.
احتمالاً cAMP آزاد شده در خارج از پلاسمالما در تنظیم فرآیندهای خارج سلولی شرکت می کند [Shiyan, Lazareva, 1988]. این دیدگاه ممکن است بر اساس کشف پروتئین کینازهای وابسته به ecto-cAMP باشد که از ترشح cAMP از سلول ها برای فعال کردن فسفوریلاسیون پروتئین ها در خارج از پلاسمالما استفاده می کنند. همچنین اعتقاد بر این است که cAMP خارج از سلول می تواند به عنوان اولین پیام رسان عمل کند [فدوروف و همکاران، 1990]، و باعث راه اندازی آبشاری از واکنش های سیستم های سیگنالینگ در سلول های همسایه شود، همانطور که در مثال قارچ های لجن چند سلولی نشان داده شد.
جلب توجه دادههای بهدستآمده از حیوانات در مورد مهار کانالهای کلسیم سلولی توسط آدنوزین اگزوژن (که میتواند به عنوان محصول تخریب cAMP در نظر گرفته شود) و فعالسازی کانالهای پتاسیم است [Orlov, Maksimova, 1999].
اطلاعات زیادی در مورد امکان تنظیم رشد قارچ های بیماری زا توسط cAMP ترشح شده، به ویژه زنگ جو، Magnaporthe grisea، که به گیاهان برنج حمله می کند، لکه های سست Ustilago maydis، Erysiphe graminis، Colletotrichum trifolii، رنگدانه Ustilago hordei است. بسته به غلظت cAMP، تحریک یا سرکوب رشد قارچ رخ داد. اعتقاد بر این است که پروتئین های هتروتریمری G در انتقال سیگنال cAMP شرکت می کنند.

اطلاعات بیشتر و بیشتری در مورد تأثیر مولکول های سیگنالینگ مختلف بر ترشح cAMP توسط سلول های گیاهی جمع می شود. نشان داده شده است که نقش ABA در سازگاری گیاه با تنش ممکن است در توانایی آن در تنظیم محتوا و آزادسازی cAMP از سلول ها باشد. فرض بر این است که کاهش محتوای cAMP تحت تأثیر ABA ناشی از افزایش ABA در محتوای Ca2 + در سیتوزول و مهار آدنیلات سیکلاز است. مشخص شده است که Ca2+ در غلظت بالا از فعالیت آدنیلات سیکلاز در یوکاریوت ها جلوگیری می کند. در همان زمان، Ca2 + می تواند محتوای cAMP را با القای افزایش فعالیت فسفودی استراز، که cAMP را هیدرولیز می کند، کاهش دهد. در واقع، فعال شدن cAMP فسفودی استراز توسط کمپلکس Ca2+-calmodulin در اجسام گیاهی کشف شد [Fedenko، 1983].
وابستگی پروفایل فسفوریلاسیون پلی پپتیدها به cAMP اگزوژن نشان داده شده است. تعداد پلی پپتیدهایی که فسفوریلاسیون آنها توسط cAMP تحریک شده بود در غلظت های cAMP میکرومولاری بیشترین بود. توجه به این واقعیت افزایش شدید فسفوریلاسیون پلی پپتید 10 کیلو دالتون در دمای پایین ناشی از cAMP جلب می شود (شکل 7) [Karimova, Zhukov, 1991; یاگوشوا، 2000]. جالب توجه است که پلی پپتید با چنین وزن مولکولی یک تنظیم کننده پروتئین cAMP فسفودی استراز است که توسط اسید آبسیزیک و Ca2+ فعال می شود و محتوای cAMP را به دلیل هیدرولیز آن توسط فسفودی استراز کاهش می دهد.
مطالعه ویژگیهای فعالسازی پروتئین کینازهای وابسته به cAMP و فسفوریلاسیون آنها از پروتئینهای مختلف، یکی از مهمترین زمینههای تحقیق در مورد سیستم سیگنال دهی آدنیلیل سیکلاز است. پروتئین کینازهای وابسته به cAMP (PKAs) آنزیم هایی هستند که با برهمکنش با cAMP فعال می شوند و انتقال باقی مانده اسید فسفریک انتهایی از ATP به گروه های هیدروکسیل باقی مانده های سرین یا ترئونین پروتئین های پذیرنده را کاتالیز می کنند. اصلاح کووالانسی پروتئین ها، که در طی فسفوریلاسیون انجام می شود، منجر به تغییر در ساختار و فعالیت کاتالیزوری آنها می شود و باعث ایجاد ارتباط یا تفکیک زیر واحدهای آنها و غیره می شود.
جرم مولکولی پروتئین ها، کیلو دالتون
برنج. 7. اثر cAMP بر فسفوریلاسیون پروتئین نهال نخود سه روزه [Karimova, Zhukov, 1991]
1-کنترل: شاخه های بریده شده توسط دمبرگ به مدت 2 ساعت به داخل آب و سپس به مدت 2 ساعت دیگر - به محلول 32 ارتوفسفات با برچسب P منتقل شدند. 2 - گیاهان قطع شده به مدت 2 ساعت به محلول 1 میکرومولار cAMP و سپس به مدت 2 ساعت دیگر - به محلول ارتوفسفات 32 P نشاندار شده منتقل شدند.
سوبستراهای واکنش پروتئین کیناز MgATP و پروتئین در حال فسفریله شدن هستند. سوبستراهای پروتئینی می توانند به طور همزمان سوبستراهایی برای پروتئین کینازهای وابسته به cGMP و cAMP در همان باقیمانده های سرین (ترئونین) باشند، اما نرخ فسفوریلاسیون وابسته به cAMP 10-15 برابر بیشتر از پروتئین کینازهای وابسته به cGMP است. سوبستراهای پروتئین کینازهای وابسته به cAMP در تمام قسمتهای سلول قرار دارند: سیتوزول، شبکه آندوپلاسمی (ER)، دستگاه گلژی، گرانولهای ترشحی، اسکلت سلولی و هسته.
پروتئین کینازهای فعال شده توسط cAMP اگزوژن از سلول های گیاهی، به عنوان مثال، از کلئوپتیل های ذرت - پروتئین کیناز 36 کیلو دالتون جدا شده اند. کاتو و همکاران سه نوع پروتئین کیناز از علف اردک Lemna paucicostata جدا شد: 165، 85 و 145 کیلو دالتون، که یکی از آنها توسط cAMP مهار شد، دیگری توسط cAMP فعال شد، و سومی مستقل از cAMP بود.
نوع دوم پروتئین کیناز پلی پپتیدهای فسفریله شده است
59، 19، 16 و 14 کیلو دالتون.
cAMP اگزوژن باعث تغییرات (عمدتاً مهار) در فسفوریلاسیون تعدادی از پلی پپتیدهای کلروپلاست، به واسطه مشارکت پروتئین کینازها شد.
یکی از اولین ژن های پروتئین کیناز شبیه سازی شده در گیاهان از نظر توالی نوکلئوتیدی مشابه خانواده پروتئین کیناز حیوانی A بود. نمونه هایی از شباهت توالی اسید آمینه پروتئین کینازهای A از گیاهان (همونولوژی آنها) با پروتئین کینازهای A از حیوانات وجود دارد. چندین گروه از محققان شبیه سازی ژن های همولوگ با ژن پروتئین کیناز A را گزارش کرده اند (بررسی: ). پروتئین کیناز از گل اطلسی یک سوبسترای مصنوعی خاص از پروتئین کیناز A را فسفریله کرد. گزارش شده است که افزودن cAMP به عصاره های گیاهی باعث تحریک فسفوریلاسیون پروتئین های خاص می شود. مطالعه محل های فسفوریلاسیون در فنیل آلانین آمونیاک لیاز (PAL)، یک آنزیم کلیدی در بیوسنتز فیتوآلکسین ها، مکان های اختصاصی برای پروتئین کیناز A را نشان داد.
استفاده از یک مهارکننده پروتئین بسیار اختصاصی (BI) پروتئین کینازهای وابسته به cAMP، تأیید این فرض را ممکن کرد که پروتئین کینازهای وابسته به cAMP می توانند توسط cAMP درون زا در طول آماده سازی نمونه فعال شوند: BI فعالیت پروتئین کیناز پایه عصاره برگ را سرکوب کرد. در آزمایش های مختلف 30-50٪ [کریموا، 1994]. واسطه های سیستم سیگنال دهی لیپوکسیژناز HDK و MeZhK فعالیت پروتئین کیناز را با 33-^8٪ در حضور cAMP فعال کردند [Karimova et al., 19996]. اسید سالیسیلیک باعث افزایش سطح فسفوریلاسیون وابسته به cAMP پلی پپتیدهای 74، 61 و 22 کیلو دالتون در برگ نخود شد [Mukhametchina، 2000]. فعالیت پروتئین کیناز تحریک شده توسط cAMP پروتئین های محلول برگ نخود به غلظت Ca2+ بستگی دارد [Karimova et al., 1989; Tarchevskaya، 1990; Karimova، Zhukov، 1991] و فعالیت آنزیمی نیز در دیوارههای سلولی جدا شده، هستهها و غشاهای پلاسمایی شناسایی شد.
ژنهایی در گیاهان یافت شده است که آنزیم پروتئین فسفاتاز را کد میکنند که هدف آن پروتئینهای فسفریله شده توسط پروتئین کیناز A است.
برای مشخص کردن سیستم سیگنال دهی آدنیلات سیکلاز، کشف در گیاهان ژنهایی که فاکتورهای تنظیمکننده رونویسی پروتئین را کد میکنند که توالیهای نوکلئوتیدی همولوگ با CREBS، فاکتور رونویسی متصل شونده به cAMP در حیوانات را گسترش دادهاند، بسیار مهم است.
دادههای متعدد در مورد تأثیر cAMP بر کانالهای یونی سلولهای گیاهی و یک مبنای تجربی نسبتاً ضعیف برای ایدههایی در مورد امکان انتقال سیگنال از cAMP از طریق فسفوریلاسیون فاکتورهای تنظیمکننده رونویسی پروتئین به ژنوم، از یک سو، موقعیت حامیان را تقویت میکند. وجود یک مسیر سیگنال دهی غیرمستقیم (از طریق فعال سازی کانال های یونی) آدنیلات سیکلاز و از سوی دیگر، ما را مجبور به تشدید تلاش ها برای به دست آوردن شواهدی از عملکرد مسیر سیگنالینگ cAMP مستقیم می کند.

سیستم سیگنالینگ MAR KINASE
پروتئین کینازهای نوع سرین ترئونین فعال شده با میتوژن (MAPK) و آبشار سیگنالینگ کیناز MAP (سیگنال -> گیرنده -> پروتئین های G -> MAPKKK - "
-> MAPKK -> MAPK -> PSF -> ژنوم)، که به اندازه کافی به طور کامل در اشیاء حیوانی مورد مطالعه قرار گرفته اند، در سلول های گیاهی نیز عمل می کنند (شکل 8). مقالات مروری به آنها اختصاص داده شده است
و کارهایی با ماهیت آزمایشی که اطلاعاتی در مورد نمایندگان منفرد این سیستم سیگنالینگ و به ویژه ارائه می دهد
مشکلات تنظیم آنها
آبشار کیناز MAP در طی میتوز (که نام این پروتئین کینازها را توضیح می دهد)، در طول کم آبی "روشن" می شود.
نیا، هیپواسموز
تنش تیک، دمای پایین، تحریک مکانیکی گیاهان
آسیب بافتی، استرس اکسیداتیو، عمل پاتوژن ها، السیتورها (در
از جمله هارپین، کریپتوژئین، الیگوساکاریدها)، فیتوهورمونهای استرس جاسمونات، سالی-
سیلات، سیستمین، اتیلن).
وابستگی عملکرد آبشار کیناز MAP به تأثیرات مختلف در نام برخی از کینازهای MAP، به عنوان مثال WIPK و SIPK (به ترتیب) منعکس شده است.
پروتئین کینازهای ناشی از زخم ورید و پروتئین ناشی از سالیسیلات
برنج. 8. طرح عملکرد سیستم سیگنالینگ کیناز MAP
KKMARK، MAP کیناز کیناز کیناز. KMARK - MAP کیناز کیناز؛ MAPK - پروتئین کیناز فعال شده با میتوژن. نامگذاریهای دیگر - شکل را ببینید. 6
n1.doc
UDC 58 BBK 28.57 T22سردبیر اجرایی عضو مسئول آکادمی علوم روسیه A.I. گرچکین
داوران:
L.H. گوردوندکترای علوم زیستی، استاد L.P. خوخلوا
تارشفسکی I.A.
سیستم های سیگنالینگ سلول های گیاهی / I.A. تارشفسکی؛ [پاسخ ویرایش A.N. گرچکین]. - M.: Nauka، 2002. - 294 p.: ill. شابک 5-02-006411-4
پیوندهای زنجیره اطلاعات تعامل بین پاتوژنها و گیاهان، از جمله محرکها، گیرندههای برانگیزاننده، پروتئینهای G، پروتئین کینازها و پروتئین فسفاتازها، عوامل تنظیمکننده رونویسی، برنامهریزی مجدد بیان ژن و پاسخ سلولی در نظر گرفته میشوند. توجه اصلی به تجزیه و تحلیل ویژگی های عملکرد سیستم های سیگنال دهی سلول های گیاهی منفرد - آدنیلات سیکلاز، MAP کیناز، فسفاتیدات، کلسیم، لیپوکسیژناز، NADPH اکسیداز، NO سنتاز و پروتون، تعامل و ادغام آنها در یک شبکه سیگنالینگ واحد است. طبقه بندی پروتئین های ناشی از پاتوژن با توجه به ویژگی های عملکردی آنها پیشنهاد شده است. داده ها در مورد گیاهان تراریخته با افزایش مقاومت در برابر عوامل بیماری زا ارائه شده است.
برای متخصصان در زمینه فیزیولوژی گیاهی، بیوشیمیست ها، بیوفیزیکدانان، متخصصان ژنتیک، آسیب شناسان گیاهی، اکولوژیست ها، آگروبیولوژیست ها.
از طریق شبکه AK
تارشفسکی I.A.
سیستم های سیگنالینگ سلول گیاهی /1.A. تارشفسکی؛ . - M.: Nauka، 2002. - 294 ص. il شابک 5-02-006411-4
این کتاب درباره اعضای زنجیرههای سیگنالی تعامل پاتوژنها و گیاه-میزبان، یعنی برانگیزانندهها، گیرندهها، پروتئینهای G، پروتئین کینازها و پروتئین فسفاتازها، فاکتورهای رونویسی برنامهریزی مجدد بیان ژنها، پاسخ سلولی بحث میکند. بخش اصلی کتاب به عملکرد سیستم های سیگنال دهی سلولی جداگانه اختصاص دارد: آدنیلات سیکلاز، MAP کیناز، فسفاتیدات، کلسیم، لیپوکسی-ژناز، NADPH-اکسیداز، NO-سینتاز، سیستم های پروتون. مفهوم اتصالات سیستم های سیگنالینگ سلولی و ادغام آنها با شبکه سیگنالینگ سلولی عمومی در حال توسعه است. نویسنده طبقهبندی پروتئینهای مرتبط با بیماریزا را بر اساس ویژگیهای عملکردی آنها پیشنهاد کرده است. داده های مربوط به گیاهان تراریخته با افزایش مقاومت در برابر عوامل بیماری زا ارائه شده است.
برای فیزیولوژیست ها، بیوشیمیست ها، بیوفیزیکدانان، ژنتیک، آسیب شناسان گیاهی، اکولوژیست ها و آگروبیولوژیست ها
شابک 5-02-006411-4
© آکادمی علوم روسیه، 2002 © انتشارات "Nauka"
(طراحی هنری)، 2002
در سالهای اخیر، تحقیقات در مورد مکانیسمهای مولکولی تنظیم بیان ژن تحت تأثیر تغییر شرایط زندگی به سرعت در حال توسعه است. در سلولهای گیاهی، وجود زنجیرههای سیگنالی کشف شد که با کمک پروتئینهای گیرنده ویژه، که در بیشتر موارد در پلاسمالما قرار دارند، تکانههای سیگنال را درک کرده، تبدیل، تقویت و به ژنوم سلول منتقل میکنند و باعث برنامهریزی مجدد بیان ژن و تغییرات در متابولیسم (از جمله موارد اصلی)، مرتبط با گنجاندن ژن های قبلاً "ساکت" و خاموش شدن برخی از ژن های فعال. اهمیت سیستم های سیگنال دهی سلولی با مطالعه مکانیسم های عمل فیتوهورمون ها نشان داده شد. نقش تعیین کننده سیستم های سیگنالینگ در شکل گیری سندرم سازگاری (استرس) ناشی از عملکرد عوامل استرس زای غیر زنده و زیستی بر روی گیاهان نیز نشان داده شد.
فقدان آثار مروری که تمام پیوندهای سیستم های سیگنالینگ مختلف را تجزیه و تحلیل کند، از ویژگی های سیگنال های درک شده و گیرنده های آنها، تبدیل تکانه های سیگنال و انتقال آنها به هسته و پایان دادن به تغییرات چشمگیر در متابولیسم سلولی و ساختار آنها. ، نویسنده را مجبور کرد تا با کمک کتابی که در اختیار خوانندگان قرار گرفته است، این خلأ را پر کند. باید در نظر داشت که مطالعه حوزه اطلاعات سلول ها هنوز تا تکمیل بسیار فاصله دارد و بسیاری از جزئیات ساختار و عملکرد آن به اندازه کافی روشن نشده است. همه اینها محققان جدید را جذب می کند، که خلاصه ای از انتشارات در مورد سیستم های سیگنالینگ سلول گیاهی به ویژه برای آنها مفید خواهد بود. متأسفانه، همه بررسی ها نیست
مقالاتی با ماهیت تجربی در کتابشناسی گنجانده شد که تا حدی به حجم محدود کتاب و زمان تهیه آن بستگی داشت. نویسنده از همکارانی که تحقیقاتشان در کتاب منعکس نشده عذرخواهی می کند.
نویسنده از همکاران خود که در مطالعه مشترک سیستم های سیگنال دهی سلول های گیاهی شرکت کردند تشکر می کند. نویسنده از پروفسور F.G. کریموا، داوطلبان علوم زیستی V.G. یاکولووا و E.V. آسافوا، ع.ر. موخا متشین و دانشیار T.M. نیکولایوا برای کمک در تهیه نسخه خطی برای انتشار.
این کار با حمایت مالی بنیاد مدرسه علمی پیشرو فدراسیون روسیه (کمک های مالی 96-15-97940 و 00-15-97904) و بنیاد تحقیقات پایه روسیه (کمک مالی 01-04-48-785) انجام شد. ).
معرفی
یکی از مهمترین مشکلات زیستشناسی مدرن، رمزگشایی مکانیسمهای پاسخ موجودات پروکاریوتی و یوکاریوتی به تغییرات در شرایط وجودی آنها، بهویژه عملکرد عوامل شدید (عوامل استرس یا عوامل استرسزا) است که باعث ایجاد حالت استرس در سلول ها.
در فرآیند تکامل، سلولها سازگاریهایی ایجاد کردهاند که به آنها امکان میدهد سیگنالهای طبیعت شیمیایی و فیزیکی را که از محیط میآیند درک، تبدیل و تقویت کنند و با کمک دستگاه ژنتیکی به آنها واکنش نشان دهند، نه تنها با شرایط تغییریافته سازگار شوند. ، متابولیسم و ساختار آنها را بازسازی می کند، بلکه ترکیبات مختلف فرار و غیرفرار را در فضای خارج سلولی برجسته می کند. برخی از آنها به عنوان مواد محافظ در برابر پاتوژن ها عمل می کنند، در حالی که برخی دیگر را می توان به عنوان مولکول های سیگنالی در نظر گرفت که باعث واکنش سلول های دیگر می شود که در فاصله زیادی از محل اثر سیگنال اولیه روی گیاهان قرار دارند.
ما می توانیم فرض کنیم که همه این رویدادهای تطبیقی در نتیجه تغییرات در زمینه اطلاعات سلول ها رخ می دهد. سیگنال های اولیه از طریق سیستم های سیگنال دهی مختلف باعث پاسخی از ژنوم سلول می شوند که در برنامه ریزی مجدد بیان ژن آشکار می شود. در واقع، سیستم های سیگنالینگ عملکرد مخزن اصلی اطلاعات - مولکول های DNA را تنظیم می کنند. از طرفی خود آنها تحت کنترل ژنوم هستند.
برای اولین بار در کشور ما، E.S شروع به مطالعه هدفمند سیستم های سیگنالینگ سلولی کرد. Severin [Severin, Kochetkova, 1991] در مورد اشیاء حیوانی و O.N. کولاوا [Kulaeva et al., 1989; کولاوا، 1990؛ کولاوا و همکاران، 1992; کولاوا، 1995؛ بورخانوا و همکاران، 1999] - روی گیاهان.
مونوگراف ارائه شده به خوانندگان شامل خلاصه ای از نتایج مطالعه تأثیر عوامل استرس زای زیستی بر عملکرد سیستم های پیام رسانی سلول های گیاهی است. در حال حاضر سیستم های سیگنالینگ MAP کیناز، آدنیلات سیکلاز، فسفاتیدات، کلسیم، لیپوکسیژناز، NADPH اکسیداز، NO سنتاز و پروتون و نقش آنها در رشد انتوژنتیکی گیاهان و در شکل گیری پاسخ به تغییر شرایط زندگی، به ویژه تأثیر انواع غیرزیستی و استرس های زیستی نویسنده تصمیم گرفت فقط بر روی آخرین جنبه این مشکل تمرکز کند - روی مکانیسم های مولکولی پاسخ گیاه به عمل پاتوژن ها، به ویژه از آنجایی که تعدادی از هورمون های گیاهی در این پاسخ و روشن کردن ویژگی های تعامل سیگنالینگ سلول های گیاهی نقش دارند. سیستم های با آنها توجه بسیاری از محققان را به خود جلب می کند.
قرار گرفتن در معرض عوامل استرس زای زیستی منجر به پاسخ گیاه می شود که به طور گسترده ای مشابه پاسخ به عوامل استرس زا غیر زنده است. این بیماری با مجموعه ای از واکنش های غیر اختصاصی مشخص می شود که باعث می شود آن را سندرم سازگاری یا استرس نامید. به طور طبیعی، بسته به نوع عامل استرس زا، ویژگی های خاصی از پاسخ نیز ممکن است شناسایی شود، با این حال، با افزایش درجه تأثیر آن، تغییرات غیراختصاصی به میزان فزاینده ای نمایان می شود [Meyerson, 1986; تارشفسکی، 1993]. بیشترین توجه به N.S. وودنسکی (ایده هایی در مورد پارابیوز)، D.S. ناسونوف و وی. الکساندروف (ایده هایی در مورد پارانکروز)، G. Selye - در آثار اختصاص داده شده به استرس در حیوانات، V.Ya. الکساندروف - در تحقیق در مورد اساس مولکولی استرس.
مهمترین تغییرات غیراختصاصی در طول استرس زیستی شامل موارد زیر است:
فازیسیته در دوره زمانی پاسخ به عمل یک پاتوژن.
افزایش کاتابولیسم لیپیدها و بیوپلیمرها.
افزایش محتوای رادیکال های آزاد در بافت ها.
اسیدی شدن سیتوزول با فعال شدن بعدی پمپ های پروتون، که pH را به مقدار اولیه خود باز می گرداند.
افزایش محتوای یون های کلسیم در سیتوزول با
فعال شدن بعدی کلسیم ATPases.
آزاد شدن یون های پتاسیم و کلر از سلول ها.
افت پتانسیل غشا (در پلاسمالما).
کاهش شدت کلی سنتز بیوپلیمرها و لیپیدها.
توقف سنتز پروتئین های خاص.
تقویت سنتز یا سنتز موارد گمشده
به نام پروتئین های محافظ قابل القای پاتوژن (chi-
تینازها (3-1،3-گلوکانازها، مهارکننده های پروتئیناز و غیره).
تشدید سنتز تقویت سلولی
اجزای دیوار - لیگنین، سوبرین، کوتین، کالوز،
پروتئین غنی از هیدروکسی پرولین
سنتز ترکیبات غیر فرار ضد بیماری زا - فیتوالکسین ها.
سنتز و جداسازی باکتریکشهای فرار و عملکردی
ترکیبات هیسیدال (هگزنال ها، نونهال ها، ترپن ها و
تقویت سنتز و افزایش محتوا (یا بر اساس
پدیده) هورمون های گیاهی استرس - آبسیزیک، جاسمو-
جدید، اسید سالیسیلیک، اتیلن، هورمون پپتیدی
ماهیت سیستمین
مهار فتوسنتز.
توزیع مجدد کربن از |4 CO 2 جذب شده در
فرآیند فتوسنتز، در میان ترکیبات مختلف -
کاهش ادغام برچسب در ترکیبات با پلیمر بالا (پروتئین ها، نشاسته) و ساکارز و افزایش (اغلب مربوط به
تلوز - به عنوان درصد کربن جذب شده) - به آلانین،
مالات، آسپارتات [Tarchevsky، 1964].
فعال سازی یک اکسیداز جایگزین که جهت انتقال الکترون را در میتوکندری تغییر می دهد.
18. نقض فراساختار - تغییرات در نازک
ساختار دانه ای هسته، کاهش تعداد پلی زوم ها و
دیکتوزوم ها، تورم میتوکندری ها و کلروپلاست ها، کاهش می یابد
کاهش تعداد تیلاکوئیدها در کلروپلاست، بازسازی سیتو
اسکلت
آپوپتوز (مرگ برنامه ریزی شده) سلول های تحت
در معرض پاتوژن ها و عوامل مجاور آنها قرار می گیرند.
ظاهر به اصطلاح غیر اختصاصی سیستمیک
مقاومت بالا در برابر عوامل بیماری زا در مکان های دور
قرار گرفتن در معرض عوامل بیماری زا در مناطق (به عنوان مثال، متامریک
اندام های گیاهان.
با افزایش مطالعه مکانیسمهای پاسخ گیاه به پاتوژنها، پاسخهای غیراختصاصی جدیدی از سلولهای گیاهی کشف میشوند. اینها شامل مسیرهای سیگنالینگ ناشناخته قبلی است.
هنگام روشن کردن ویژگیهای عملکرد سیستمهای سیگنالینگ، باید در نظر داشت که این مسائل بخشی از یک مشکل کلیتر تنظیم عملکرد ژنوم است. لازم به ذکر است که جهانی بودن ساختار حامل های اصلی اطلاعات سلول های موجودات مختلف - DNA و ژن ها - یکپارچگی مکانیسم هایی را که در خدمت اجرای این اطلاعات هستند از پیش تعیین می کند [Grechkin, Tarchevsky, 2000]. این مربوط به تکثیر و رونویسی DNA، ساختار و مکانیسم عمل ریبوزوم ها، و همچنین مکانیسم های تنظیم بیان ژن با تغییر شرایط وجود سلول با استفاده از مجموعه ای از سیستم های سیگنال دهی تا حد زیادی جهانی است. پیوندهای سیستم های سیگنالینگ نیز اساساً یکپارچه هستند (طبیعت که در یک زمان راه حل ساختاری و عملکردی بهینه را برای یک مسئله بیوشیمیایی یا اطلاعاتی یافته است، آن را در فرآیند تکامل حفظ و تکرار می کند). در بیشتر موارد، طیف وسیعی از سیگنالهای شیمیایی که از محیط میآیند، با کمک «آنتنهای» ویژه - مولکولهای پروتئین گیرنده که به غشای سلول نفوذ میکنند و بالای سطوح خارجی و داخلی آن بیرون میزنند، توسط سلول گرفته میشود.
هیچ طرف. چندین نوع ساختار این گیرنده ها در سلول های گیاهی و جانوری یکپارچه هستند. برهمکنش غیر کووالانسی ناحیه خارجی گیرنده با یک یا مولکول سیگنال دهنده دیگر که از محیط اطراف سلول می آید منجر به تغییر در ساختار پروتئین گیرنده می شود که به ناحیه داخلی و سیتوپلاسمی منتقل می شود. در اکثر سیستم های سیگنالینگ، پروتئین های G واسطه با آن در تماس هستند - واحد دیگری از سیستم های سیگنالینگ که یکپارچه است (در ساختار و عملکرد آن). پروتئینهای G عملکرد یک مبدل سیگنال را انجام میدهند و یک تکانه ساختاری سیگنال را به آنزیم شروع کننده مخصوص یک سیستم سیگنال دهی خاص منتقل میکنند. آنزیم های شروع کننده یک نوع سیستم سیگنالینگ در اجسام مختلف نیز جهانی هستند و دارای مناطق گسترده ای با توالی اسید آمینه یکسان هستند. یکی از مهمترین پیوندهای یکپارچه در سیستم های سیگنالینگ پروتئین کینازها (آنزیم هایی که باقیمانده نهایی اسید اورتوفسفریک را از ATP به پروتئین های خاصی منتقل می کنند) هستند که توسط محصولات شروع واکنش های سیگنالینگ یا مشتقات آنها فعال می شوند. پروتئین های فسفریله شده توسط پروتئین کینازها حلقه های بعدی در زنجیره سیگنال هستند. یکی دیگر از پیوندهای یکپارچه در سیستم های سیگنالینگ سلولی فاکتورهای تنظیم کننده رونویسی پروتئین است که یکی از بسترهای واکنش های پروتئین کیناز است. ساختار این پروتئین ها نیز تا حد زیادی یکپارچه است، و تغییرات ساختار، وابستگی عوامل تنظیم کننده رونویسی را به یک یا آن سیستم سیگنالینگ تعیین می کند. فسفوریلاسیون عوامل تنظیم کننده رونویسی باعث تغییر در ترکیب این پروتئین ها، فعال شدن و متعاقب آن برهمکنش با ناحیه پروموتر یک ژن خاص می شود که منجر به تغییر در شدت بیان آن (القا یا سرکوب) و در موارد شدید می شود. ، به "روشن کردن" یا "خاموش" برخی از ژن های خاموش. فعال. برنامه ریزی مجدد بیان مجموعه ای از ژن ها در ژنوم باعث تغییر نسبت پروتئین ها در سلول می شود که اساس پاسخ عملکردی آن است. در برخی موارد، یک سیگنال شیمیایی از محیط خارجی می تواند با یک گیرنده واقع در داخل سلول - در سیتوزول یا
سیگنال ها
NIB
برنج. 1. طرح تعامل سیگنال های خارجی با گیرنده های سلولی
1,5,6- گیرنده های واقع در پلاسمالما؛ 2,4 - گیرنده های واقع در سیتوزول؛ 3 - آنزیم شروع سیستم سیگنالینگ که در پلاسمالما قرار دارد. 5 - گیرنده ای که تحت تأثیر تغییر غیر اختصاصی در ساختار جزء لیپیدی پلاسمالما فعال می شود. SIB - پروتئین های ناشی از سیگنال؛ PTF - فاکتورهای تنظیم کننده رونویسی پروتئین؛ i|/ - تغییر در پتانسیل غشا
همان هسته (شکل 1). در سلول های حیوانی، چنین سیگنال هایی، برای مثال، هورمون های استروئیدی هستند. این مسیر اطلاعاتی تعداد واسطه های کمتری دارد و بنابراین فرصت های کمتری برای تنظیم توسط سلول دارد.
کشور ما همیشه به مشکلات ایمنی گیاهی توجه زیادی داشته است. تعدادی تک نگاری و بررسی توسط دانشمندان داخلی به این مشکل اختصاص یافته است [Sukhorukov, 1952; وردروفسکی، 1959; واویلف، 1964; گورلنکو، 1968; روبین و همکاران، 1975; متلیتسکی، 1976; توکین، 1980; متلیتسکی و همکاران، 1984; متلیتسکی، اوزرتکوسکایا، 1985; Kursano-va، 1988; Ilyinskaya و همکاران، 1991; Ozeretskovskaya و همکاران، 1993; کورابلوا، پلاتونوا، 1995; Chernov et al., 1996; تارشفسکی، چرنوف، 2000].
در سال های اخیر توجه ویژه ای به مکانیسم های مولکولی ایمنی گیاهی شده است. نشان داده شده است که
هنگامی که گیاهان آلوده میشوند، سیستمهای سیگنالینگ مختلفی فعال میشوند که سیگنالها را از عوامل بیماریزا به دستگاه ژنتیکی سلولها، جایی که بیان ژنهای محافظ رخ میدهد، درک، تکثیر و منتقل میکنند، و به گیاهان اجازه میدهد تا حفاظت ساختاری و شیمیایی در برابر عوامل بیماریزا را سازماندهی کنند. پیشرفتها در این زمینه با شبیهسازی ژنها، رمزگشایی ساختار اولیه آنها (از جمله نواحی پروموتر)، ساختار پروتئینهایی که کدگذاری میکنند، استفاده از فعالکنندهها و مهارکنندههای بخشهای منفرد سیستمهای سیگنال، و همچنین جهشیافتهها و گیاهان تراریخته مرتبط است. با ژنهای معرفیشده مسئول سنتز شرکتکنندگان گیرنده، انتقال و تقویت سیگنالها. در مطالعه سیستمهای سیگنالدهی سلولهای گیاهی، ساخت گیاهان تراریخته با محرکهای ژنهای پروتئینهای شرکتکننده در سیستمهای سیگنالینگ نقش مهمی ایفا میکند.
در حال حاضر، سیستم های سیگنال دهی سلول های گیاهی تحت تنش زیستی به شدت در مؤسسه بیوشیمی مورد مطالعه قرار می گیرند. A.N. باخ RAS، موسسه بیوشیمی و بیوفیزیک کازان RAS، موسسه فیزیولوژی گیاهی RAS، شعبه پوشچینو از موسسه شیمی بیورگانیک RAS، مرکز مهندسی زیستی RAS، دانشگاههای دولتی مسکو و سنت پترزبورگ، موسسه تحقیقاتی بیوتکنولوژی کشاورزی روسیه روسیه آکادمی علوم کشاورزی، مؤسسه تحقیقاتی تمام روسیه آسیب شناسی گیاهی آکادمی علوم کشاورزی روسیه و غیره.
مشکل رمزگشایی مکانیسمهای مولکولی تنش زیستی، از جمله نقش سیستمهای سیگنالینگ در توسعه آن، فیزیولوژیستها و بیوشیمیدانان گیاهی، میکروبیولوژیستها، ژنتیکشناسان، زیستشناسان مولکولی و آسیبشناسان گیاهی را در ده سال گذشته متحد کرده است. تعداد زیادی مقاله تجربی و مروری در مورد جنبه های مختلف این مشکل منتشر شده است (از جمله در مجلات ویژه: "Physiological and Molecular Plant Pathology"، "Molecular Plant - Microbe Interactions"، "Annual Review of Plant Physiology and Pathology"). در عین حال، در ادبیات داخلی تعمیم آثار اختصاص داده شده به سیستم های سیگنالینگ سلولی وجود ندارد، که نویسنده را به نیاز به نوشتن تک نگاری ارائه شده به خوانندگان سوق داد.
پاتوژن ها و الایزیتورها
بیماری های گیاهی توسط هزاران گونه از میکروارگانیسم ها ایجاد می شود که می توان آنها را به سه گروه تقسیم کرد: ویروس ها (بیش از 40 خانواده) و ویروس ها. باکتری ها (Agrobacterium، Corynebacterium، Erwinia، Pseudomonas، Xanthomonas، Streptomyces) و میکروارگانیسم های شبه مایکوپلاسما؛ قارچ ها (پایین تر: پلاسمودیوفورومیست ها، چیتریدومیست ها، اوومیست ها؛ بالاتر: آسکومیست ها، بازیدیومیست ها، دوترومیست ها).
پایان نامه آنزیم های محافظ: فنیل آلانین آمونیاک لیاز و آنیون پراکسیداز. فرم های بدون بال متعلق به این زیر طبقه در نتیجه از دست دادن این اندام ها در طول تکامل فرم های بالدار ظاهر شدند. این زیرگروه شامل 20 راسته حشره است که در میان آنها پلی فاژهایی وجود دارند که ویژگی خاصی نسبت به گیاه ندارند، اولیگوفاژها و مونوفاژها که در آنها ویژگی تعامل بین پاتوژن و گیاه میزبان به وضوح بیان می شود. برخی از حشرات از برگ ها (کل تیغه برگ یا اسکلتی شدن برگ)، برخی دیگر از ساقه ها (از جمله جویدن ساقه از داخل)، تخمدان های گل، میوه ها و ریشه ها تغذیه می کنند. شته ها و سیکادا شیره رگ های عروقی را با استفاده از پروبوسیس یا استیل می مکند.
با وجود اقدامات انجام شده برای مبارزه با حشرات، مشکل مبرم کاهش آسیب ناشی از آنها همچنان وجود دارد. در حال حاضر، بیش از 12 درصد از عملکرد گیاهان کشاورزی روی کره زمین در نتیجه حمله میکروارگانیسمهای بیماریزا، نماتدها و حشرات از بین میرود.
آسیب به سلول ها منجر به تخریب محتویات آنها می شود، به عنوان مثال، ترکیبات پلیمری بالا، و ظهور مولکول های سیگنال دهی الیگومری. این "کشتی های غرق شده" [Tarchevsky، 1993] به سلول های همسایه می رسند و باعث ایجاد یک واکنش محافظتی در آنها می شوند، از جمله تغییر در بیان ژن و تشکیل پروتئین های محافظی که آنها رمزگذاری می کنند. اغلب، آسیب مکانیکی به گیاهان با عفونت همراه است، زیرا سطح زخم باز می شود که از طریق آن عوامل بیماری زا به گیاه نفوذ می کنند. علاوه بر این، میکروارگانیسم های بیماریزای گیاهی می توانند در قسمت های دهان حشرات زندگی کنند. به عنوان مثال، مشخص است که ناقلان عفونت مایکوپلاسما سیکادا هستند، که در آن شکل های بالغ و لارو از آب آوندهای غربال گیاهان تغذیه می کنند، برگ ها را با پروبوسیس خود سوراخ می کنند.

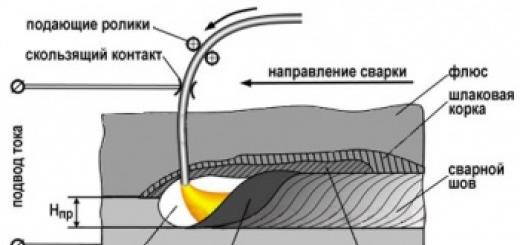
برنج. 2. طرح برهمکنش بین یک سلول بیماریزا و یک گیاه میزبان
/ - کوتیناز؛ 2 - محصولات تخریب اجزای کوتیکول (احتمالا دارای خواص سیگنال دهی). 3 - (3-گلوکاناز و سایر گلیکوزیلازهایی که توسط پاتوژن دفع می شوند. 4 - الایسیتورها - قطعات دیواره سلول میزبان (CW). 5 - کیتینازها و سایر گلیکوزیلازها که به طور مخرب روی CS پاتوژن عمل می کنند. 6 - الایسیتورها - قطعات پاتوژن CS. 7 - فیتوالکسین ها - مهار کننده های پروتئینازها، کوتینازها، گلیکوزیلازها و سایر آنزیم های بیماری زا. 8 - مواد سمی پاتوژن؛ 9- تقویت CS میزبان به دلیل فعال شدن پراکسیدازها و افزایش سنتز لیگنین، رسوب پروتئین های هیدروکسی پرولین و لکتین ها. 10 - محرک های حساسیت و نکروز سلول های همسایه؛ // - محصولات تخریب کوتین که بر روی سلول های پاتوژن عمل می کنند
ساقه های جوان. برگ خرطومی رز بر خلاف سایر اعضای برگ خوار، محتویات سلول ها را می مکد. سیکادا نسبت به حشرات برگ خوار آسیب کمتری به بافت گیاه وارد می کند، با این حال، گیاهان می توانند به همان روشی که به عفونت گیاهی مرتبط با آن واکنش نشان دهند.
سلول های بیماری زا در تماس با گیاهان، ترکیبات مختلفی را آزاد می کنند که نفوذ آنها به گیاه، تغذیه و نمو آنها را تضمین می کند (شکل 2). برخی از این ترکیبات سمومی هستند که پاتوژن ها برای تضعیف مقاومت میزبان ترشح می کنند. در حال حاضر، بیش از 20 سموم اختصاصی میزبان تولید شده توسط قارچ های بیماری زا توصیف شده است.

برنج. 3. ترکیب فیتوتوکسیک از Cochlio-bolus carbonum
باکتری ها و قارچ ها نیز سموم غیرانتخابی تولید می کنند، به ویژه فوزیکوسین، اریکوستن، کرواتین، فاز-الوتوکسین، سیرنگومایسین، تابتوکسین.
یکی از سموم اختصاصی میزبان ترشح شده توسط Pyrenophora triticirepentis یک پروتئین 13.2 کیلو دالتون است، سایرین محصولات متابولیسم ثانویه با ساختارهای مختلف هستند - اینها پلی کتیدها، ترپنوئیدها، ساکاریدها، پپتیدهای حلقوی و غیره هستند.
به عنوان یک قاعده، دومی شامل پپتیدهایی است که سنتز آنها در خارج از ریبوزوم ها اتفاق می افتد و حاوی باقی مانده های اسید آمینه D هستند. به عنوان مثال، سم اختصاصی میزبان از Cochliobolus carbonum دارای ساختار حلقوی تتراپپتیدی است. (D- npo- L- آنا- D- آنا- L- آ3 جی جی), که در آن آخرین علامت اختصاری به معنای اسید 2-آمینو-9،10-اپوکسی-8-oxo-de-canoic است (شکل 3). این سم در سلول های پاتوژن با استفاده از توکسین سنتاز تولید می شود. مقاومت در برابر این ترکیب در ذرت بستگی به ژن کد کننده کربونیل ردوکتاز وابسته به NADPH دارد که باعث کاهش گروه کربونیل می شود و در نتیجه
غیرفعال کردن سم. مشخص شد که در گیاه میزبان، سم باعث مهار هیستون داستیلازها و در نتیجه، بیش از حد استیلاسیون هیستون می شود. این واکنش دفاعی گیاه ناشی از عفونت پاتوژن را سرکوب می کند.
نوع دیگری از ترکیباتی که توسط عوامل بیماری زا ترشح می شوند، السیتر (از انگلیسی elicit - شناسایی کردن، ایجاد کردن) نامیده می شوند. اصطلاح جمعی "Elicator" برای اولین بار در سال 1972 برای نشان دادن سیگنالهای شیمیایی که در محلهای آلودگی گیاه توسط میکروارگانیسمهای بیماریزا ایجاد میشوند، پیشنهاد شد و به طور گسترده گسترش یافته است.
الیسیتورها نقش سیگنال های اولیه را بازی می کنند و شبکه پیچیده ای از فرآیندهای القاء و تنظیم ایمنی گیاهی را فعال می کنند. این در سنتز پروتئین های محافظ، آنتی بیوتیک های غیر فرار گیاهی - فیتوالکسین ها، در انتشار ترکیبات فرار ضد بیماری زا، و غیره آشکار می شود. در حال حاضر، ساختار بسیاری از الیسیتورهای طبیعی مشخص شده است. برخی از آنها توسط میکروارگانیسم ها تولید می شوند، برخی دیگر (برانگیختن ثانویه) در طی تجزیه آنزیمی ترکیبات پلیمری بالا کوتیکول و پلی ساکاریدهای دیواره سلولی گیاهان و میکروارگانیسم ها تشکیل می شوند، برخی دیگر فیتوهورمون های استرس هستند که سنتز آنها در گیاهان است. ناشی از عوامل بیماری زا و عوامل استرس زای زیست زا. مهم ترین محرک ها شامل ترکیبات پروتئینی دفع شده توسط باکتری ها و قارچ های بیماری زا و همچنین پروتئین های پوششی ویروسی است. الیسیتورهای پروتئینی که بیشتر مورد مطالعه قرار گرفته اند را می توان الیسیتین های کوچک (10 کیلو دالتون)، محافظه کارانه، آبدوست، غنی شده با سیستئین، که توسط همه گونه های Phytophthora و Pythium مورد مطالعه ترشح می شود، در نظر گرفت. به عنوان مثال، این موارد شامل کریپتوژین است.
الیزیتین ها باعث افزایش حساسیت و مرگ سلول های آلوده به ویژه در گیاهان از جنس Nicotiana می شوند. شدیدترین تشکیل الیسیتین ها توسط بلایت دیررس در طول رشد میکرو
مشخص شد که الیسیتین ها قادر به انتقال استرول ها از طریق غشاها هستند، زیرا آنها یک محل اتصال استرول دارند. بسیاری از قارچهای بیماریزا نمیتوانند استرولها را سنتز کنند، که نقش الیسیتینها را نه تنها در تغذیه میکروارگانیسمها، بلکه در القای واکنش محافظتی در گیاهان نیز مشخص میکند. یک الیسیتور گلیکوپروتئین 42 کیلو دالتون از سوختگی دیررس جدا شد. فعالیت و اتصال آن به گیرنده پروتئین غشای پلاسما، که فرم مونومر آن یک پروتئین 100 کیلو دالتون است، توسط یک قطعه الیگوپپتیدی متشکل از 13 باقیمانده اسید آمینه تضمین شد. یک پپتید الیسیتور مخصوص نژاد متشکل از 28 باقیمانده اسید آمینه با سه گروه دی سولفید از قارچ بیماریزای گیاهی Cladosporium fulvum به دست آمد و پپتید از یک پیش ماده حاوی 63 اسید آمینه تشکیل شد. این فاکتور بیخطری همولوژی ساختاری با تعدادی از پپتیدهای کوچک، مانند مهارکنندههای کربوکسی پپتیداز و مسدودکنندههای کانال یونی، و متصل به پروتئین گیرنده پلاسمالما نشان داد، که ظاهراً باعث مدولاسیون، دیمر شدن و انتقال یک سیگنال سیگنال به سیستمهای سیگنالینگ میشود. از پیش پروتئین بزرگتر کلادوسپوریوم فولووم، متشکل از 135 اسید آمینه، پردازش پس از ترجمه، یک پروتئین محرک از 106 اسید آمینه تولید می کند. پروتئین های السیتور تولید شده توسط قارچ زنگ زده Uromyces vignae دو پلی پپتید کوچک 5.6 و 5.8 کیلو دالتون هستند که خواصی بر خلاف سایر الیسیتین ها دارند. در میان مولدهای پروتئین باکتریایی، هارپین بیشترین مطالعه را دارد. بسیاری از باکتری های بیماریزای گیاهی الیگوپپتیدهای السیتور تولید می کنند (که توسط مواد مصنوعی آنها ایجاد می شود
آنالوگ های آسمان)، مربوط به حفاظت شده ترین مناطق پروتئین - فلاژلین است عامل مهمحدت این باکتری ها یک پروتئین السیتور جدید از Erwinia amylovora جدا شده است که ناحیه C آن همولوگ با آنزیم پکتات لیاز است که میتواند باعث ظهور قطعات الیگومری السیتور - محصولات تخریب پکتین شود. باکتری بیماری زا Erwinia carotovora پروتئین استخراج کننده هارپین و آنزیم های پکتات لیاز، سلولاز، پلی گالاکتوروناز و پروتئازها را دفع می کند که اجزای پلیمری دیواره سلولی گیاه میزبان را هیدرولیز می کند (شکل 2 را ببینید) و در نتیجه باعث تشکیل الیگومرهای الیگومریک می شود. . جالب توجه است که پکتات لیاز ترشح شده توسط Erwinia chrysanthemi در نتیجه پردازش خارج سلولی فعالیت به دست آورد.
برخی از لیپیدها و مشتقات آنها نیز متعلق به الایسیتورها هستند، به ویژه اسیدهای چرب غیراشباع 20 کربنی برخی از پاتوژن ها - اسید آراشیدونیک و اسید ایکوزاپنتانوئیک [Ilyinskaya et al., 1991; Ozerets-kovskaya و همکاران، 1993; Ozeretskovskaya، 1994; Gilyazetdinov و همکاران، 1995; Ilyinskaya و همکاران، 1996a، b; Ilyinskaya، Ozeretskovskaya، 1998]، و مشتقات اکسیژن دار آنها. کار مروری [Ilyinskaya و همکاران، 1991] دادههای مربوط به اثر برانگیزاننده لیپیدها (لیپوپروتئینها) تولید شده توسط قارچهای بیماریزا بر روی گیاهان را خلاصه میکند. مشخص شد که این بخش پروتئینی لیپوپروتئین ها نیست که اثر برانگیزاننده دارد، بلکه بخش لیپیدی آنها است که اسیدهای آراشیدونیک (ایکوزاتترانوئیک) و ایکوزوپنتانوئیک هستند که مشخصه گیاهان عالی نیستند. آنها باعث تشکیل فیتوالکسین ها، نکروز بافتی و مقاومت سیستمیک گیاهان در برابر پاتوژن های مختلف شدند. فرآورده های تبدیل لیپوکسیژناز در بافت های گیاهی اسیدهای چرب C 20 (هیدروپروکسی، هیدروکسی، اکسو، مشتقات حلقوی، لکوترین ها) که در سلول های گیاه میزبان با کمک آنزیم کمپلکس لیپوکسیژناز (سوبستراهای آن می توان اسیدهای چرب پلی ین C، 8 و C 20) تأثیر قوی بر پاسخ حفاظتی گیاهان داشتند. این ظاهراً با این واقعیت توضیح داده می شود که در گیاهان غیر آلوده اکسیژن وجود ندارد.
مشتقات ذاتی اسیدهای چرب 20 کربنی است و ظاهر آنها در نتیجه عفونت منجر به نتایج چشمگیری می شود، مانند ایجاد نکروز در اطراف سلول های آلوده که مانعی در برابر انتشار عوامل بیماری زا در سراسر گیاه ایجاد می کند.
شواهدی وجود دارد مبنی بر اینکه القای فعالیت لیپوکسیژناز توسط یک پاتوژن منجر به تشکیل یک پاسخ گیاهی می شود حتی در مواردی که الیسیتور حاوی اسیدهای چرب C20 نبود و بستر فعالیت لیپوکسیژناز فقط می تواند اسیدهای چرب C18 پلی ان خودش باشد. محصولات اکتادکانوئیدها بودند، نه ایکوزانوئیدها. سیرنگولیدها [L et al., 1998] و سربروزیدها، ترکیبات اسفنگولیپید، نیز دارای خواص برانگیخته هستند. Cerebroside A و C جدا شده از Magnaporthe grisea فعال ترین محرک ها در گیاهان برنج بودند. محصولات تخریب سربروزید (متیل استرهای اسید چرب، بازهای اسفنگوئیدی، بازهای گلیکوزیل-اسفنگوئید) فعالیت محرک را نشان ندادند.
برخی از الیسیتورها در نتیجه عمل هیدرولازهای ترشح شده توسط پاتوژن ها بر روی بافت گیاهی تشکیل می شوند. هدف هیدرولازها دو چیز است. از یک طرف، آنها تغذیه پاتوژن های لازم برای رشد و تولیدمثل آنها را فراهم می کنند، از طرف دیگر، موانع مکانیکی را که مانع ورود پاتوژن ها به زیستگاه آنها در گیاهان می شوند، از بین می برند.
یکی از این موانع، کوتیکول است که عمدتاً از یک هتروپلیمر کوتین تشکیل شده است که در موم جاسازی شده است. بیش از 20 مونومر کشف شده است که کوتین را تشکیل می دهند. اینها اسیدهای چرب اشباع و غیر اشباع و الکلها با طولهای مختلف از جمله اسیدهای هیدروکسیله و اپوکسید شده، اسیدهای دی کربوکسیلیک با زنجیره بلند و غیره هستند. در کوتین، بیشتر گروههای الکل اولیه در تشکیل پیوندهای استری و همچنین برخی از گروههای الکل ثانویه که پیوندهای متقاطع بین زنجیرهها و نقاط شاخه در پلیمر را ایجاد میکنند، شرکت میکنند. بخشی از پلیمر "مدافع" دیگر، سوبرین، از نظر ترکیب نزدیک به کوتین است. تفاوت اصلی آن در این است که اسیدهای چرب آزاد جزء اصلی واکس های سوبریک هستند، در حالی که تعداد بسیار کمی از آنها در کوتین وجود دارد. علاوه بر این، در سوبرینا
به طور عمده الکل های چرب C22 و C24 وجود دارد، در حالی که کوتین حاوی C26 و C28 است. برای غلبه بر سد مکانیکی سطحی گیاهان، بسیاری از قارچهای بیماریزا آنزیمهایی ترشح میکنند که کوتین و بخشی از اجزای سوبرین را هیدرولیز میکنند. محصولات واکنش کوتیناز اسیدهای چرب و الکل های مختلف اکسیژن دار، عمدتاً اسیدهای 10،16-دی هیدروکسی-Sk- و 9،10،18-تری هیدروکسی-C|8، بودند که مولکول های سیگنالی هستند که تشکیل و آزادسازی اضافی را القا می کنند. مقادیر کوتیناز، کوتین را "خورده" می کند و نفوذ قارچ را به گیاه تسهیل می کند. مشخص شد که دوره تاخیر برای ظهور mRNA کوتیناز در قارچ پس از شروع تشکیل اسیدهای دی و تری هیدروکسی ذکر شده در بالا تنها 15 دقیقه است و دوره تاخیر برای آزادسازی کوتیناز اضافی دو برابر است. طولانی آسیب به ژن کوتیناز در Fusarium solani تا حد زیادی باعث کاهش حدت این قارچ شد. مهار کوتیناز با استفاده از مواد شیمیایی یا آنتی بادی ها از عفونت گیاه جلوگیری می کند. این فرض که محصولات تخریب کوتین اکسیژن دار نه تنها می توانند به عنوان محرک های تشکیل کوتیناز در پاتوژن ها عمل کنند، بلکه به عنوان محرک واکنش های دفاعی در گیاه میزبان نیز عمل می کنند [Tarchevsky, 1993] متعاقباً تأیید شد.
پس از نفوذ میکروارگانیسمهای بیماریزا از طریق کوتیکول، برخی از آنها به داخل دستههای آوندی گیاهان حرکت کرده و از موجود در آنجا برای رشد خود استفاده میکنند. مواد مغذی، در حالی که بقیه به داخل سلول های میزبان زنده منتقل می شوند. در هر صورت، پاتوژن ها با یک مانع مکانیکی دیگر روبرو می شوند - دیواره های سلولی، متشکل از پلی ساکاریدها و پروتئین های مختلف و در بیشتر موارد با یک پلیمر سخت - لیگنین تقویت شده است [Tarchevsky, Marchenko, 1987; تارشفسکی، مارچنکو، 1991]. همانطور که در بالا ذکر شد، برای غلبه بر این مانع و تامین رشد آنها با تغذیه کربوهیدرات و نیتروژن، پاتوژن ها آنزیم هایی ترشح می کنند که پلی ساکاریدها و پروتئین های دیواره سلولی را هیدرولیز می کنند.
مطالعات ویژه نشان داده است که در طی برهمکنش باکتری ها و بافت های گیاه میزبان، آنزیم ها
تخریب ها به طور همزمان ظاهر نمی شوند. به عنوان مثال، پکتیل متیل استراز در زیر گونه Erwinia carotovora تلقیح نشده نیز وجود داشت. آتروسپتی در بافت غده سیب زمینی، در حالی که فعالیت پلی گالاکتوراناز، پکتات لیاز، سلولاز، پروتئاز و زایلاناز به ترتیب 10، 14، 16، 19 و 22 ساعت پس از تلقیح ظاهر شد.
مشخص شد که محصولات تخریب الیگوساکارید پلی ساکاریدهای دیواره سلولی گیاهی دارای خاصیت تحریک کننده هستند. اما الیگوساکاریدهای فعال نیز می توانند توسط پلی ساکاریدهایی که بخشی از دیواره سلولی پاتوژن ها هستند تشکیل شوند. شناخته شده است که یکی از راه های محافظت از گیاهان در برابر میکروارگانیسم های بیماری زا، تشکیل پس از عفونت و انتشار آنزیم هایی در خارج از پلاسمالم - کیتیناز و β-1،3-گلوکاناز است که پلی ساکاریدهای کیتین و β-1،3- را هیدرولیز می کند. پلی گلوکان های دیواره سلولی پاتوژن ها، که منجر به سرکوب رشد و توسعه آنها می شود. مشخص شد که محصولات الیگوساکارید چنین هیدرولیز نیز محرکهای فعال واکنشهای دفاعی گیاه هستند. در نتیجه عمل الیگوساکاریدها، مقاومت گیاه در برابر عفونت باکتریایی، قارچی یا ویروسی افزایش می یابد.
تعدادی از مقالات مروری به محرکهای الیگوساکارید، ساختار، فعالیت، گیرندهها، «روشن کردن» سیستمهای سیگنالدهی سلولی، القای بیان ژنهای محافظ، سنتز فیتوالکسینها، واکنشهای حساسیت مفرط و سایر پاسخهای گیاهی اختصاص داده شده است.
در آزمایشگاه Elbersheim و سپس در تعدادی از آزمایشگاههای دیگر، نشان داده شد که الیگوگلیکوزیدهای ایجاد شده در نتیجه تجزیه آندوگلیکوزیداز ناشی از بیماریزای همی سلولزها و مواد پکتین گیاهان، کیتین و کیتوزان قارچها، میتوانند نقش مواد فعال بیولوژیکی را ایفا کنند. . حتی پیشنهاد شده است که آنها را یک کلاس جدید از هورمون ها ("الیگوساکارین"، در مقابل الیگوساکاریدها، که هیچ فعالیتی ندارند) در نظر گرفته شوند. تشکیل الیگوساکاریدها در نتیجه هیدرولیز پلی ساکاریدها، و نه در طول سنتز از مونوساکاریدها، با این مثال نشان داده شد.
الیگوساکارید زایلگلوکان با اثر آنتی اکسین.
ساختار تعدادی از الیگوساکاریدهای فعال فیزیولوژیکی رمزگشایی شد: یک هپتاگلوکوزید منشعب به دست آمده از دیواره سلولی یک قارچ بیماریزا [Elbersheim, Darvill, 1985]. پنتا و هگزامرهای N-استیل گلوکزامین به دست آمده از هیدرولیز کیتین و همچنین گلوکزامین حاصل از هیدرولیز کیتوزان. 9-13-mer oligogalacturonides خطی تشکیل شده در طول هیدرولیز مواد پکتین. دکاگالاکتورونید با 4-5 باقیمانده گالاکتورونوزیل انتهایی غیراشباع. الیگوگالاکتورونوزیدها با درجه پلیمریزاسیون 2-6، فعالیت خاصی از خود نشان می دهند. دادهها در مورد زایلگلوکانهای فعال فیزیولوژیکی بهدستآمده از همی سلولزها با درجه پلیمریزاسیون 8-9، کیتوبیوز، کیتو-تریوز و کیتوتتروز، قطعات زایلگلوکان شاخهدار با فرمول Glu(4)-Xi(3)-Gal(1 یا 2) منتشر شده است. )-Fuc و مشتقات طبیعی O-استیله شده آنها. مشخص شد که p-گلوکوزید شاخه دار دارای بالاترین فعالیت القا کننده فیتوالکسین است. اصلاح شیمیایی این الیگوساکارین یا تغییر در الگوی انشعاب منجر به کاهش خواص السیتور شد.
مطالعه مکانیسم اثر الیگوساکاریدها بر روی گیاهان این امکان را فراهم کرد که مشخص شود طیف پاسخ ها به غلظت و ساختار مواد مورد مطالعه بستگی دارد. اليگوساكاريدهاي مختلف بيشترين فعاليت را در غلظت هاي مختلف نشان مي دهند. به عنوان مثال، القای سنتز ترکیبات محافظ (کیتینازها) در کشت سلولی برنج در غلظت N-استیل کیتوهگزاوز 1 میکروگرم بر میلی لیتر حداکثر بود، در حالی که برای دستیابی به همان اثر در مورد هگزاوز لامینارین (قطعه (3- 1،3-گلوکان) 10 برابر غلظت بیشتری مورد نیاز بود.
مشخص شد که درجه مقاومت گیاه به پاتوژن (همراه با سایر عوامل) با نسبت پلی ساکاریدهای مختلف دیواره سلولی گیاه تعیین می شود. این را می توان بر اساس مقایسه Colletotrichum linde مقاوم و حساس به پاتوژن قضاوت کرد.
لاین های لوبیا موتیانوم که در معرض آندوپلی گالاکتروناز پاتوژن قرار گرفتند. قطعات الیگومر از پکتین جدا شد. معلوم شد که داشتند تنوع مقاومبقایای قندهای خنثی غالب است و در قندهای ناپایدار - آنهایی که گالاکترونات هستند.
اخیراً نتایجی به دست آمده است که نشان میدهد قطعات الیگوگالاکتورونات در گیاهان نه تنها تحت تأثیر آنزیمهای تجزیهکننده پکتین پاتوژنها، بلکه در نتیجه بیان ژنهای پلیگالاکتوروناز در سلولهای میزبان در پاسخ به الیسیتورهای سیستمین و الیگوساکارید تشکیل میشوند.
تنظیم چند جهته پاسخ محافظ سلول ها توسط محصولات تخریب پلی ساکاریدهای دیواره سلولی توجه را به خود جلب می کند. معلوم شد که الیگوگالاکتورونیدهای کوچک با درجه پلیمریزاسیون 2-3 محرک فعال هستند و قطعات پکتین رامنوگالاکتورونیک با درجه پلیمریزاسیون بالا سرکوب کننده تشکیل پروتئین هیدروکسی پرولین دیواره سلولی هستند. به عبارت دیگر، فرآیندهای تخریب در دیواره های سلولی ناشی از عوامل بیماری زا می توانند (در نتیجه توالی پیچیده ای از واکنش های سیستم های سیگنالینگ سلولی) فرآیندهای بیوسنتزی را تنظیم کنند که باعث افزایش پایداری دیواره سلولی به دلیل تجمع پروتئین های هیدروکسی پرولین و تشکیل کووالانسی می شود. پیوندهای بین آنها
قطعات حاوی فوکوز زایل گلوکان (سه و پنتاساکاریدها) دارای خواص سرکوب کننده سیستم ایمنی بودند، اما هنگام جایگزینی زایلوز با مونوساکارید دیگر، فعالیت سرکوبگر را به فعالیت برانگیزاننده تغییر دادند [Ilyinskaya et al., 1997]. محرومیت از الیگوساکارید فوکوز، آن را از هر دو خاصیت سرکوبگر و برانگیخته محروم کرد. دوزهای فعال کم و انتخاب بالای سرکوبگرهای خاص، ماهیت گیرنده عمل آنها را نشان می دهد [Ozeretskovskaya، 2001].
نمونههای دیگری از پاتوژنها وجود دارد که نه تنها محرکها، بلکه سرکوبکنندههای واکنشهای دفاعی گیاه را نیز تولید میکنند. بنابراین، pycnosgyurs Mycosphaerella pinodes هر دو نوع از این ترکیبات را ترشح کردند.
لازم به ذکر است که قطعات الیگوساکارید پلی ساکاریدهای دیواره سلولی گیاهان و قارچ ها از
آنها به عنوان محرک های غیر نژادی خاص استفاده می شوند که باعث واکنش های حفاظتی غیر اختصاصی در گیاهان آلوده می شوند. این قابل درک است، زیرا در طی تخریب پلی ساکاریدها طیف گسترده ای از الیگوساکاریدها تشکیل می شود که در آن ویژگی گونه ای پاتوژن یا میزبان بسیار ضعیف بیان می شود. در عین حال، فاکتورهای حدت باکتریایی پروتئین (یا پپتید)، که توسط گیرندههای سلول گیاهی "خود" شناسایی میشوند، برای نژاد خاص هستند. نوع اخیر برهمکنش، پینگ پنگ ژنتیکی یا برهمکنش ژن روی ژن نامیده میشود، زیرا ویژگی عامل یا گیرنده توسط ژنهای کدکننده آنها تعیین میشود و مقاومت یا حساسیت گیاهان به پاتوژن توسط عوامل بیماریزا تعیین میشود. توانایی گیرنده در تشخیص محرک
برای مطالعه مکانیسمهای پاسخ سلولهای گیاهی به عمل الیسیتورها، اغلب از الیگوساکاریدهای منفرد استفاده نمیشود، بلکه مخلوطی از الیگوساکاریدها در طول هیدرولیز پلی ساکاریدهای دیواره سلولی قارچهای بیماریزا تشکیل میشوند. این رویکرد اگر در نظر بگیریم که حتی در اولین لحظات آلودگی توسط پاتوژن ها، سلول های گیاهی می توانند نه یک، بلکه چندین عامل تحریک کننده را تحت تأثیر قرار دهند، توجیه می شود. به هر حال، آثار نسبتا کمی وجود دارد که به مطالعه ویژگی های عملکرد چندین عامل به طور همزمان اختصاص داده شده است. به عنوان مثال، نشان داده شده است که الیسیتینهای پارازیتیسئین و کریپتوژئین، و همچنین الیگوساکاریدها از دیوارههای سلولی، باعث فعالسازی سریع پروتئین کیناز نوع SIP 48 کیلو دالتون و فنیل آلانین آمونیوم لیاز در تنباکو میشوند. در همان زمان، این الیسیتین ها بودند و نه اولیگوساکاریدها که پروتئین کیناز 40 کیلو دالتون را فعال کردند. گلوکان و Ca2+ اثر آراشیدونات و ایکوزاپن-تانوات را افزایش دادند. این واقعیت که EGTA (یک لیگاند اختصاصی Ca2+) سنتز فیتوالکسین ها را مهار می کند، این امکان را فراهم می کند که ادعا کنیم یون های کلسیم نقش مهمی در تنظیم عملکرد محافظتی گیاهان دارند. این امکان وجود دارد که مواد سیگنال دهنده نیز محصولات تخریب پروتئین های دیواره سلولی غنی از باقیمانده هیدروکسی پرولین و حاوی شاخه های اولیگوگلیکوزیل باشند.
گیرنده های الایسیتور
قبلاً در مقدمه ذکر شد که گیرندههای سیگنالهای الیسیتور را میتوان در غشای سلولی، در سیتوزول و در هسته قرار داد، اما ما بهویژه به اولین و رایجترین مورد علاقهمندیم، زمانی که خود الیسیتور به داخل بدن نفوذ نمیکند. سلول، اما با بخش خارج سلولی گیرنده پروتئین غشای پلاسما، که اولین پیوند در زنجیره پیچیده ای از رویدادهای سیگنالینگ است که در واکنش سلول به شرایط زندگی تغییر یافته به اوج خود می رسد، تعامل دارد. تعداد آنتن های مولکولی یک نوع گیرنده غشای پلاسمایی سلولی ظاهراً می تواند به چندین هزار برسد. تعداد انواع آنتن های مولکولی ناشناخته باقی مانده است، اما می توان استدلال کرد که آنها دارای خواص ساختاری یکپارچه هستند. آنها دارای سه حوزه اصلی هستند: یک دامنه N ترمینال متغیر خارجی (پذیرنده در ارتباط با السیتورها)، یک دامنه گذر غشایی با محتوای افزایش یافته اسید آمینه آبگریز لوسین، و یک دامنه C ترمینال متغیر سیتوپلاسمی، که ساختار آن تعیین کننده است. انتقال یک سیگنال سیگنال به یک سیستم سیگنالینگ خاص. یک گیرنده ممکن است فقط برای یک نوع السیتر یا برای گروهی از الایسیتورهای مرتبط (مثلاً الیگومریک) خاص باشد. چندین نوع پروتئین گیرنده غشای سلولی در حیوانات توصیف شده است: در برخی از گیرنده ها، زنجیره گذرنده پروتئین تنها یک بار از غشاء عبور می کند، در برخی دیگر (سرپانتین) - هفت بار، در برخی دیگر، تعامل با لیگاند محرک منجر به تشکیل همو یا هترودایمر (الیگومر)، که مبدل اولیه سیگنال خارجی است. ساختار پروتئین های گیرنده پلاسمالمای گیاهی به میزان کمتری مورد مطالعه قرار گرفته است، اما اصول ساخت آنها یکسان است.

ATP
ATP
برنج. 4. طرح ساختار یک سیستم سیگنال دهی گیرنده دو جزئی
آ -گیرنده ساده؛ ب -گیرنده چند پیوندی 1 - دامنه "ورودی"؛ 2 - دامنه هیستیدین اتوکیناز; 3 - دامنه گیرنده تنظیم کننده پاسخ; 4 - دامنه "خروجی" تنظیم کننده پاسخ؛ 5 - دامنه انتقال فسفات حاوی هیستیدین; الف - باقی مانده اسید آسپارتیک؛ G - باقی مانده هیستیدین؛ P یک باقیمانده ارتوفسفات است که در طی واکنش های کیناز منتقل می شود. سیگنال خارجی با نماد رعد و برق نشان داده می شود
مانند سلول های حیوانی. ساختار گیرنده دو جزئی که دارای خواص پروتئین کیناز است توجه ویژه ای را به خود جلب می کند (شکل 4). ابتدا در موجودات پروکاریوتی و سپس به شکل اصلاح شده در موجودات یوکاریوتی از جمله گیاهان مانند آرابیدوپسیس کشف شد. اگر در مورد اول دو جزء - خود گیرنده و عامل اجرایی - مستقل باشند، اگرچه در تعامل هستند، مولکول های پروتئین، در مورد دوم آنها دو حوزه از یک پروتئین هستند.
تایید نقش برهمکنشهای گیرنده و برهمکنش در انتقال و انتقال سیگنالها از پاتوژنها به ژنوم، ایجاد یک همبستگی مثبت بین توانایی الیسیتورها برای اتصال غیرکووالانسی به گیرندهها و ایجاد پاسخ سلولی محافظ، مانند تجمع فیتوالکسین ها اتصال به بخش خارجی گیرنده های پروتئین غشای پلاسما مشخصه الیگوساکاریدهای الیگوساکارید دیواره سلولی گیاهی، قطعات الیگوشیتین دیواره سلولی قارچی، پروتئین ها و پپتیدهای مولد، سیرنگولیدها، فیتوهورمون های استرس سیستمین، اتیلن، اسید آبسیزیک، متیل استروئیدس و متیل جابز بود. در مورد دوم، یک تفاوت اساسی با سلول های حیوانی وجود دارد که در آن گیرنده های هورمون استروئیدی در هسته قرار دارند.
تعدادی از گیرنده های استخراج کننده پروتئین غشایی جدا شده اند. برای انجام این کار، پس از اتصال گیرندهها به الیسیتورهای برچسبدار، غشاها از سلولها آزاد میشوند، از بین میروند و پروتئین با الیسیتور باقیمانده با رادیواکتیویته آن شناسایی میشود. به عنوان مثال، کشف شده است که گیرنده سیستمین یک پروتئین 160 کیلو دالتون، مولد باکتری فلاژلین یک پروتئین غشایی 115 کیلو دالتون و یک گلیکوپروتئین از دیواره سلولی بلایت دیررس است که دارای یک قطعه الیگوپپتیدی سیگنال 13 آمینو است. باقی مانده های اسید -91 کیلو دالتون یا 100 کیلو دالتون.
مفهوم برهمکنش مولکولی ژن به ژن بین پاتوژن ها و گیاهان اغلب شامل تشخیص غیرمستقیم (با واسطه سیستم های سیگنالینگ) ژن غیر ویروسی پاتوژن (ژن avr) توسط ژن مقاومت مربوطه آن (ژن R) سلول گیاهی است.
اساس مولکولی تعامل "ژن به ژن" بین یک پاتوژن و یک گیاه، مدل گیرنده-گیرنده بود. پروتئین های گیرنده جدا و خالص شده اند و ژن های کد کننده این پروتئین ها شبیه سازی شده اند. تعدادی کار مروری وجود دارد که به ساختار پروتئین های گیرنده اختصاص داده شده است
مشخص شد که بسیاری از آنها تکرارهای غنی از لوسین حفظ شده مشابه (از 12 تا 21) دارند که برای تعامل پروتئین-پروتئین ضروری است. این تکرارها واسطه اتصال پروتئین گیرنده R به الیسیتورها هستند. مطالعات جهشیافتهها با مقاومت ضعیف در برابر باکتریهای بیماریزا ناشی از جایگزینی گلوتامات با لیزین در یکی از تکرارهای لوسین تأیید میکند که برهمکنش پروتئین-پروتئین پیوند مهمی در تبدیل و انتقال سیگنالهای السیتور به ژنوم سلول است.
در حال حاضر، چندین مدل از ساختار گیرنده و روشهای انتقال سیگنال الیسیتور از خارج به داخل سلول گیاهی پذیرفته شده است. خانواده ای متشکل از 35 گیرنده سرپانتین در آرابیدوپسیس یافت شده است. گیرنده مولکول سیگنال را در محل N ترمینال در سمت بیرونی غشاء درک می کند و سیگنال سیگنال را از طریق سایت C داخلی به سیتوپلاسم منتقل می کند. اتصال یک مولکول سیگنال منجر به تغییر در ساختار کل مولکول گیرنده می شود که باعث فعال شدن مولکول های پروتئین مرتبط با آن در سیتوپلاسم می شود که سیگنال را انتقال می دهند.
یکی از مکانیسم های اساسی مورد استفاده در سیستم های سیگنال دهی سلولی، دیمریزاسیون (الیگومریزاسیون) برخی از واسطه های پروتئینی این سیستم ها است. به عنوان مثال می توان به دیمریزاسیون گیرنده ها پس از اتصال لیگاندها به آنها، دیمر شدن برخی از واسطه های سیستم های سیگنالینگ و دیمر شدن عوامل تنظیم کننده رونویسی اشاره کرد. هم همو و هم هترودایمریزاسیون (الیگومریزاسیون) مشاهده می شود. در حیوانات، مکانیسم دیمر شدن گیرنده های تیروزین کیناز غشای سلولی مشخص است، به عنوان مثال، برای انتقال هورمون های پلی پپتیدی (فاکتور رشد جفت و غیره). گیرنده های سرین/ترئونین کیناز به روشی مشابه عمل می کنند. اطلاعات کمی در مورد این که کدام شکل از گیرنده ها - مونومر، همودیمر یا هترودیمریک - در تبدیل سیگنال های السیتور در سلول های گیاهی دخیل هستند، وجود دارد. طرحی از هترودایمر مجدد
گیرنده، که توسط یک لیگاند فعال می شود، که منجر به فسفوریلاسیون دامنه سیتوزولی کیناز و فعال شدن پروتئین های مرتبط با آن می شود، که برخی از آنها یک سیگنال سیگنال را به واسطه های سیستم های سیگنالینگ زیر منتقل می کنند. یکی از پروتئین های مرتبط پروتئین فسفاتاز است که دامنه کیناز را غیرفعال می کند.
در سلول های حیوانی، گیرنده تیروزین کیناز از سه حوزه - خارج سلولی، ترانس غشایی و سیتوزولی تشکیل شده است. ساختار خاص حوزه های اول و سوم (مثلاً شامل این واقعیت است که آنها قادر به فسفوریلاسیون نیستند) از یک طرف تعیین می کند که گیرنده با کدام هورمون تعامل دارد و از طرف دیگر، کدام سیستم های سیگنال دهی هستند. توسط این هورمون "روشن" شده است. برهمکنش حوزه خارجی با لیگاند سیگنالینگ منجر به اتوفسفوریلاسیون باقیمانده تیروزین این دامنه می شود که فعالیت کیناز آن را افزایش می دهد. به طور معمول، پروتئین کینازها حاوی چندین محل فسفوریلاسیون هستند. این در مورد پروتئین کینازهای گیرنده نیز صدق می کند. دامنه سیتوپلاسمی فرم مونومر گیرنده فاکتور رشد در سلول های حیوانی حاوی حداقل نه باقیمانده تیروزین اتوفسفریل پذیر است. یکی از آنها، Tyr 857، برای تجلی فعالیت کیناز مهم است، و هشت مورد دیگر ویژگی ارتباط با مولکولهایی را تعیین میکنند که سیگنال را تبدیل میکنند. دلیلی وجود دارد که باور کنیم از همان اصول عملکرد گیرنده در سلولهای گیاهی نیز استفاده میشود، با این حال، عمدتاً پروتئین کینازهای گیرنده سرین ترئونین که در واکنشهای دفاعی گیاهی ناشی از بیماریزا نقش دارند در آنها یافت میشود.
در حال حاضر، 18 پروتئین کیناز سرین-ترئونین گیرنده آرابیدوپسیس بسته به ساختار دامنه خارج سلولی آنها به چهار گروه تقسیم می شوند:
1. پروتئین کینازها با دامنه های غنی شده با تکرارهای لوسین، که معمولاً مشخصه قطعات درگیر در برهمکنش پروتئین-پروتئین است. در حیوانات، چنین گیرنده هایی به مولکول های سیگنالینگ پلی پپتیدی (یا پپتیدی) متصل می شوند. فرض بر این است که این گروه شامل گیرنده های براسینولید با غنی شده است
میلوسین در ناحیه فوق غشایی N ترمینال تکرار می شود. در گوجه فرنگی، ژنی برای یک پروتئین مشابه، اما بدون دامنه سیتوزولی کیناز جدا شد.
2. پروتئین کینازها با دامنه S که حاوی
بسیاری از باقی مانده های سیستئین
پروتئین کینازها با دامنه های غنی از لوسین
تکرار می شود، اما، بر خلاف گروه اول، همراه است
با لکتین ها این امر امکان پذیرایی توسط اینها را ایجاد می کند
پروتئین کینازهای الیکاتورهای الیگوساکاریدی
پروتئین کینازهای مرتبط با دیواره سلولی
یکی از انواع قدیمی، محافظه کارانه و گسترده گیرنده های غشایی، هیستیدین کینازهای اتوفسفریله کننده گذرنده غشایی هستند که می توانند توسط طیف وسیعی از مولکول های سیگنال دهی کننده فعال شوند. اتصال الیسیتور توسط ناحیه N ترمینال خارجی گیرنده، بیرون زده بالای لایه لیپیدی پلاسمالما، باعث تغییر در ترکیب آن و اتوفسفوریلاسیون باقیمانده هیستیدین می شود (شکل 4 را ببینید). سپس باقیمانده اسید فسفریک به باقی مانده آسپارتات ناحیه داخلی (سیتوپلاسمی) پروتئین منتقل می شود که باعث تغییر در ترکیب آن و در نتیجه فعال شدن آنزیم مرتبط با گیرنده می شود (مستقیما یا از طریق واسطه - اغلب پروتئین های G). فعال سازی آنزیم مهمترین پیوند در سیستم سیگنالینگ است که هدف از آن انتقال و تکثیر سیگنال السیتور است که منجر به بیان ژن های محافظ و ظهور پروتئین هایی می شود.
پاسخ سلول ها و گیاه به عنوان یک کل به عفونت و اثرات الیسیتورها مشخص می شود. اختصاصی بودن گیرنده ها برای الیسیتورها توسط انتهای N خارجی متغیر پروتئین و ویژگی آنزیم توسط C-پایانه داخلی آن تعیین می شود. نشان داده شده است که این نوع گیرنده با فیتوهورمون استرس اتیلن تعامل دارد IBleecker et al., 1998; هوآ و مایروویتز، 1998; الهیات، 1998; ووست و کیبر، 1998; آلونسو و همکاران، 1999; چانگ، شوکی، 1999; A.E. هال و همکاران، 1999; هیرایاما و همکاران، 1999; Cosgrove و همکاران، 2000; Savaldi-Goldstein, Fluhr, 2000; و غیره]، که باعث واکنش های محافظتی سلول های گیاهی می شود. شبیهسازی و تعیین ساختار اولیه ژن گیرنده هیستیدین در آرابیدوپسیس نشان داد که دامنه غشای N ترمینال آن شبیه ناقلهای یون فلزی است.
در حال حاضر، یک پروتئین گیرنده گذرنده توصیف شده است که انتهای N آن با دیواره سلولی برهمکنش دارد و پایانه C در سیتوپلاسم قرار دارد و دارای خواص پروتئین کینازهای سرین ترئونین است. به گفته نویسندگان، این پروتئین گیرنده عملکردهای سیگنالینگ را انجام می دهد و تماس سیگنالی بین دیواره سلولی و محتویات داخلی سلول را فراهم می کند.
از آنجایی که برهمکنش مولکول سیگنال و گیرنده بدون تشکیل پیوندهای کووالانسی بین آنها اتفاق می افتد، امکان جدا شدن آنها را نمی توان رد کرد. از سوی دیگر، ارتباط این دو نوع مولکول میتواند کاملاً قوی باشد و تغییر در ساختار پروتئین گیرنده، پیشنیازهایی را برای تسهیل حمله به آن توسط پروتئازها ایجاد میکند که پروتئینهای دارای ساختار مختل را تشخیص میدهند و این مولکولها را از بین میبرند. . در این راستا توانایی سلول ها در بازیابی سریع تعداد گیرنده ها از اهمیت بالایی برخوردار است. انواع مختلف. قابل توجه آزمایشهایی است که به مطالعه اثر مهارکنندههای سنتز پروتئین بر شدت اتصال الیسیتورها توسط پروتئینهای گیرنده پلاسمالما اختصاص یافته است. مشخص شد که درمان سلولها با سیکلوهگزیماید، یک مهارکننده سنتز پروتئین با مشارکت ریبوزومهای سیتوپلاسمی، باعث کاهش نسبتاً سریع سطح اتصال سیستمین به سلولها میشود، که نشان میدهد که
نرخ بالای گردش پروتئین گیرنده 160 کیلو دالتون است. داده هایی در مورد سنتز گیرنده های القا شده در پلاسمالما وجود دارد، اما تا آنجا که شناخته شده است، در حال حاضر هنوز هیچ اطلاعاتی در مورد درجه اختصاصی بودن آن وجود ندارد. سنتز یک پروتئین گیرنده خاص بسته به نوع الیسیتور.
Tarchevsky I. A. سیستم های سیگنالینگ سلول های گیاهی / resp. ویرایش A. N. Grechkin. M.: Nauka، 2002. 294 ص.
UDC 633.11 (581.14:57.04)
ویژگی های توزیع گیاهان در زراعت گندم با توجه به کلاس های تنوع عناصر بهره وری صحبت
A. A. Goryunov، M. V. Ivleva، S. A. Stepanov
شرایط رشد به طور قابل توجهی بر توزیع گیاهان در جمعیت کشاورزی گندم دوروم با توجه به طبقات تنوع در تعداد سنبلچه ها، تعداد دانه های سنبلچه و وزن آنها تأثیر می گذارد. در میان انواع انتخاب ساراتوف در شرایط شدید شرایط اقلیمی سال، تعداد متفاوتی از گیاهان مشخص است: گونه های باستانی دارای کلاس های کوچک هستند، واریته های جدید دارای کلاس های تنوع زیادی هستند. شرایط اقلیمی مساعد کشاورزی باعث افزایش تعداد گیاهان طبقه بندی شده به عنوان کلاس های بالاتر از تنوع در عناصر بهره وری بلال می شود.
کلیدواژه: رقم، سنبلچه، دانه، گندم.
ویژگیهای پراکنش گیاهان در زراعت گندم بر اساس کلاسهای تغییر عناصر بازدهی بلال
A. A. Goryunov، M. V. Ivleva، S. A. Stepanov
شرایط پوشش گیاهی اساساً بر توزیع گیاهان در جمعیت کشاورزی گندم دوروم بر طبقات مختلف تعداد سنبلچه ها، مقادیر هسته بلال و وزن آنها تأثیر می گذارد. در میان ارقام انتخابی ساراتوف در شرایط سال شدید در شرایط اقلیمی، تعداد مختلفی از گیاهان مشخص است: به ارقام قدیمی - طبقات کوچک، تا ارقام جدید - طبقات بزرگ یک تنوع. شرایط اقلیمی مساعد زراعی، تعداد گیاهانی را که به طبقات بالاتری از تنوع عناصر کارآیی یک بلال منتقل می شوند، افزایش می دهد.
کلیدواژه: رقم، سنبلچه، مغز، گندم.
در مورفوژنز گندم، به گفته محققان (Morozova، 1983، 1986)، چندین مرحله قابل تشخیص است: 1) ریخت زایی قسمت رأسی مریستم جوانه جنینی، که منجر به تشکیل شاخه اصلی ابتدایی می شود. 2) مورفوژنز عناصر فیتومر شاخه اصلی ابتدایی به اندام های گیاهی که عادت بوته را تعیین می کند. فاز اول (ارگانوژنز اولیه - طبق روستوفتسوا، 1984) ماتریس گیاه را تعیین می کند. همانطور که مشخص شد (روستوفتسوا، 1978؛ موروزوا، 1986؛ استپانوف و مستوایا، 1990؛ آدامز، 1982)، ویژگی های فرآیندهای اولیه اندامزایی در شکل گیری ساختار بعدی منعکس می شود.
تشکیل فیتومرها در ناحیه رویشی شاخساره اصلی ابتدایی، به گفته محققین (Morozova، 1986، 1988)، یک فرآیند خاص گونه است، در حالی که استقرار عناصر فیتومر شاخه اصلی ابتدایی در اندام های گیاهی فعال یک نوع است. -فرآیند خاص فرآیند تشکیل فیتومرها در ناحیه زایشی شاخساره بیشتر به تنوع خاص بستگی دارد (Morozova, 1994).
اهمیت فرآیندهای مورفوژنتیک اولیه به طور متضاد بیان می شود، به عنوان مثال. استقرار و تشکیل فیتومرهای مناطق رویشی و زایشی شاخه های گندم و اجرای بعدی آنها در شرایط اقلیمی مناسب زراعی هنگام تجزیه و تحلیل ساختار محصول بر اساس منحنی های تنوع عناصر بهره وری اندام هوایی (Morozova، 1983، 1986؛ Stepanov، 2009) . پیش از این، حسابداری انتخابی توزیع گیاهان در جمعیت کشاورزی آنها بر اساس طبقات تنوع عناصر منفرد بهره وری، به ویژه تعداد سنبلچه ها، تعداد دانه ها در بلال، جرم دانه های سنبله انجام می شود.
مواد و روش
این تحقیق در سال 2007-2009 انجام شد. ارقام زیر از گندم دوروم بهاره انتخابی ساراتوف به عنوان موضوعات مورد مطالعه انتخاب شدند: Gordeiforme 432، Melyanopus 26، Melyanopus 69، Saratovskaya 40، Saratovskaya 59، Saratovskaya Zolotistaya، Lyudmila، Valentina، Nik، Elizavetinskaya، Zolotaya Volotanas. مشاهدات و سوابق اصلی در آزمایشهای مزرعهای کرتهای کوچک در زمینههای انتخاب ایستگاه تناوب زراعی پژوهشکده کشاورزی جنوب شرق و باغ گیاهشناسی SSU انجام شد، آزمایشها 3 بار تکرار شد. برای انجام تجزیه و تحلیل ساختاری بهره وری ارقام گندم، در پایان فصل رشد، از هر تکرار 25 بوته گرفته شد و سپس در یک گروه ترکیب و 25 بوته با استفاده از نمونه گیری تصادفی برای تجزیه و تحلیل انتخاب شدند. تعداد سنبلچه ها، تعداد دانه در سنبلچه ها و وزن یک دانه در نظر گرفته شد. بر اساس داده های به دست آمده، تعیین کردیم
مطابق با روش Z. A. Morozova (1983)، ویژگی های توزیع گیاهان در جمعیت کشاورزی گندم دوروم به کلاس های تنوع در عناصر بهره وری بلال تقسیم شد. پردازش آماری نتایج تحقیق با استفاده از بسته نرم افزاری Excel Windows 2007 انجام شد.
نتایج و بحث آن
همانطور که تحقیقات ما نشان داد، در فصل رشد سال 2007، تعداد اصلی شاخه های اصلی گونه های گندم منتخب ساراتوف از نظر تعداد سنبلچه در کلاس های 2 و 3 تنوع بود. فقط تعداد کمی از گیاهان به عنوان کلاس 1 - 4٪ طبقه بندی شدند (جدول 1).
جدول 1. تعداد شاخه های گونه های گندم انتخابی ساراتوف بر اساس طبقات تنوع در تعداد سنبلچه ها، % (2007)
کلاس تنوع تنوع
1 2 3 4 5
Gordeiforme 432 0 92 8 0 0
ملانوپوس 26 4 76 20 0 0
ملانوپوس 69 4 64 32 0 0
ساراتوفسکایا 40 7 93 0 0 0
قدیمی 4 81 15 0 0
ساراتوفسکایا 59 4 76 20 0 0
ساراتوف طلایی 0 16 80 4 0
لیودمیلا 8 44 48 0 0
والنتینا 0 16 76 8 0
نیک 14 14 72 0 0
Elizavetinskaya 0 24 72 4 0
موج طلایی 8 16 52 24 0
آنوشکا 0 20 64 16 0
کراسر 0 20 48 32 0
جدید 4 27 59 10 0
هنگام تجزیه و تحلیل واریته ها بر اساس گروه، مشخص شد که نژادهای بومی با تعداد بیشتری از گیاهان از کلاس تنوع دوم (81٪) و تعداد کمتری از گیاهان از کلاس تنوع 3 (15٪) مشخص می شوند. برای گروه ارقام جدید مشخص شد که تعداد بیشتری از گیاهان متعلق به کلاس 3 تنوع (59%)، برخی از گیاهان متعلق به کلاس 4 تنوع (10%) هستند. مشخص شده است که در برخی از واریتههای جدید تعداد گیاهان کلاس چهارم بیش از 10٪ است - کراسار (32٪)، موج طلایی (24٪)، آننوشکا (16٪) و در برخی از واریته ها تعداد آنها. کمتر از 10٪ است (والنتینا،
Saratovskaya طلایی، Elizavetinskaya) یا اصلا مشاهده نشده است - Saratovskaya 59، Lyudmila، Nik (جدول 1 را ببینید).
در فصل رشد سال 2008، که با شرایط اقلیمی مطلوب تری مشخص شد، در میان گونه های انتخابی ساراتوف، اعم از قدیمی و جدید، تعداد بیشتری از گیاهان از نظر تعداد سنبلچه ها به عنوان طبقه 3 تنوع طبقه بندی شدند. هیچ یک از گیاهان، مانند سال گذشته، در تنوع کلاس 5 نشان داده نشد. مشخص است که بر خلاف گونه های جدید گندم دوروم، تعداد بیشتری از گیاهان از تنوع کلاس دوم در ارقام بومی مشاهده شد - 41٪ (جدول 2).
جدول 2. تعداد شاخه های گونه های گندم انتخابی ساراتوف بر اساس طبقات تنوع در تعداد سنبلچه ها، % (2008)
کلاس تنوع تنوع
1 2 3 4 5
Gordeiforme 432 12 20 60 8 0
ملانوپوس 26 4 36 56 4 0
ملانوپوس 69 4 48 48 0 0 0
ساراتوفسکایا 40 4 60 28 8 0
قدیمی 6 41 48 5 0
ساراتوفسکایا 59 28 48 24 0 0
ساراتوف طلایی 0 28 64 8 0
لیودمیلا 8 44 48 0 0
والنتینا 4 28 64 4 0
نیک 4 28 68 0 0
Elizavetinskaya 8 36 52 4 0
موج طلایی 4 12 68 16 0
آنوشکا 0 28 60 12 0
کراسر 8 28 32 32 0
جدید 7 32 52.5 8.5 0
در میان ارقام جدید گندم دوروم، ارقامی وجود داشت که مانند سال قبل، با وجود برخی از گیاهان در طبقه چهارم تنوع در تعداد سنبلچه مشخص شد - کراسار (32٪)، زولوتایا ولنا (16٪) ، آننوشکا (12٪)، ساراتوف طلایی (8٪)، والنتینا (4٪)، Elizavetinskaya (4٪)، یعنی همان روند در سال قبل، 2007 مشاهده شد (جدول 2 را ببینید).
در شرایط فصل رشد 2009، اکثر گیاهان گندم گونه های انتخابی ساراتوف، بر اساس تعداد سنبلچه ها، به کلاس های 4 و 3 تنوع اختصاص یافتند: گونه های جدید - به ترتیب 45 و 43٪، گونه های باستانی. - به ترتیب 30 و 51 درصد. مشخصه که برخی
برخی از گونه ها با وجود تعداد بیشتری از گیاهان از کلاس چهارم نسبت به مقدار متوسط مشخص می شوند - آنوشکا (76٪)، والنتینا (64٪)، نیک (56٪)، زولوتایا ولنا (52٪)، ساراتوفسکایا 40 (48%). در برخی از واریته ها، گیاهان درجه 5 تنوع ذکر شد - موج طلایی (12٪)، کراسار (8٪)، لیودمیلا (8٪)، گوردیفورم 432 و ساراتوفسکایا 40 - 4٪ (جدول 3).
جدول 3. تعداد شاخه های گونه های گندم انتخابی ساراتوف بر اساس طبقات تنوع در تعداد سنبلچه ها، % (2009)
کلاس تنوع تنوع
Gordeiforme 432 4 12 52 28 4
ملانوپوس 26 4 36 44 16 0
ملانوپوس 69 0 8 64 28 0
ساراتوفسکایا 40 0 4 44 48 4
قدیمی 2 15 51 30 2
ساراتوفسکایا 59 0 28 48 24 0
ساراتوف طلایی 4 8 72 16 0
لیودمیلا 0 4 56 32 8
والنتینا 0 0 36 64 0
نیک 4 4 36 56 0
Elizavetinskaya 4 12 40 44 0
موج طلایی 0 4 32 52 12
آنوشکا 0 0 24 76 0
کراسر 0 8 40 44 8
جدید 1 8 43 45 3
بنابراین، مطالعات انجام شده نشان داد که شرایط رشد به طور قابل توجهی بر توزیع گیاهان در جمعیت کشاورزی با توجه به طبقات تنوع در تعداد سنبلچه ها تأثیر می گذارد. در میان گونه های انتخابی ساراتوف در شرایط شدید اقلیم کشاورزی سال، تعداد بیشتری از گیاهان مشخص است: گونه های باستانی - کلاس 2، گونه های جدید - کلاس 3، و برخی از آنها دارای تغییرات کلاس 4 هستند. در شرایط اقلیمی مطلوب کشاورزی، تعداد گیاهان طبقه بندی شده به عنوان طبقات بالاتر از تنوع در تعداد سنبلچه های گندم دوروم افزایش می یابد.
در شرایط فصل رشد سال 2007، تعداد شاخه های اصلی گونه های گندم منتخب ساراتوف از نظر تعداد دانه در بلال در کلاس های 1 و 2 تنوع قرار داشت. تنها بخشی از گیاهان برخی از واریته ها در کلاس های 3، 4 و 5 طبقه بندی شدند (جدول 4).
کلاس تنوع تنوع
1 2 3 4 5
Gordeiforme 432 96 4 0 0 0
ملانوپوس 26 96 4 0 0 0
ملانوپوس 69 92 8 0 0 0
ساراتوفسکایا 40 93 7 0 0 0
قدیمی 94 6 0 0 0
ساراتوفسکایا 59 80 20 0 0 0
ساراتوف طلایی 20 48 32 0 0
لیودمیلا 0 64 24 12 0
والنتینا 48 36 16 0 0
نیک 28 62 10 0 0
Elizavetinskaya 48 48 4 0 0
موج طلایی 12 32 48 4 4
آنوشکا 52 36 12 0 0
کراسر 88 8 4 0 0
جدید 42 39 17 1.5 0.5
هنگام تجزیه و تحلیل واریتهها بر اساس گروه، مشخص شد که نژادهای بومی با تعداد بیشتری از گیاهان کلاس تنوع 1 (94٪) و نسبت بسیار کمی از گیاهان کلاس تنوع 2 (6٪) مشخص میشوند. برای گروه گونه های جدید، مشخص شد که تعداد بیشتری از گیاهان از گونه های فردی نیز به کلاس 1 تنوع تعلق دارند - کراسار (88٪)، ساراتوفسکایا 59 (80٪)، آننوشکا (52٪)، والنتینا (48٪). ٪، Elizavetinskaya (48٪)، واریته های فردی - به کلاس 2 تنوع - لیودمیلا (64٪)، نیک (62٪)، ساراتوف زولوتیستایا (48٪)، Elizavetinskaya (48٪)، یا به کلاس 3 - طلایی موج - 48٪ (جدول 3 را ببینید). در دو گونه، گیاهان کلاس 4 تنوع در تعداد دانه های بلال ذکر شد - لیودمیلا (12٪) و زولوتایا ولنا - 4٪ (جدول 4 را ببینید).
در طول فصل رشد سال 2008، که همانطور که قبلا ذکر شد، با شرایط اقلیمی مطلوب تری مشخص شد، در بین انواع انتخاب ساراتوف، چه باستانی و چه جدید، تعداد بیشتری از گیاهان از نظر تعداد سنبلچه ها به رتبه دوم اختصاص یافتند. و کلاس های 3 تنوع . با این حال، در میان نژادهای بومی، دو گونه با تعداد زیادی از گیاهان کلاس 2 نسبت به مقادیر متوسط متمایز شدند - Saratovskaya 40 و Melyanopus 69 - 72 و 48٪. در میان گونه های جدید، 3 گونه نیز با تعداد زیادی از گیاهان کلاس 2 نسبت به مقادیر متوسط متمایز شدند - Saratovskaya 59 و Valentina (72٪)، لیودمیلا - 64٪.
برخلاف سال گذشته، در میان انواع انتخاب ساراتوف، تعداد مشخصی از گیاهان طبقه بندی شده به عنوان طبقه چهارم تنوع در تعداد دانه های بلال وجود دارد. این امر به ویژه در مورد انواع Melyanopus 26، Elizavetinskaya، Lyudmila، Gordeiforme 432، Melyanopus 69، Nik، Annushka صادق است (جدول 5).
جدول 5. تعداد شاخه های گونه های گندم انتخابی ساراتوف بر اساس طبقات تنوع در تعداد دانه های بلال، % (2008)
کلاس تنوع تنوع
1 2 3 4 5
Gordeiforme 432 0 28 56 8 8
ملانوپوس 26 0 24 48 24 4
ملانوپوس 69 4 48 40 8 0
ساراتوفسکایا 40 0 72 24 4 0
قدیمی 1 43 42 11 3
ساراتوفسکایا 59 20 72 8 0 0
ساراتوف طلایی 4 36 56 4 0
لیودمیلا 0 64 24 12 0
والنتینا 0 72 28 0 0
نیک 0 32 60 8 0
Elizavetinskaya 0 48 32 20 0
موج طلایی 12 32 48 4 4
آنوشکا 4 44 40 8 4
کراسر 4 40 52 4 0
جدید 5 49 39 6 1
در شرایط فصل رشد سال 2009، توزیع گیاهان گندم گونه های انتخابی ساراتوف بر اساس تعداد سنبلچه ها بسته به وابستگی گروه - گونه های قدیمی یا جدید - متفاوت بود. در گروه تودهها، بیشتر گیاهان به ترتیب 5/42 و 27 درصد در کلاسهای 3 و 4 طبقهبندی شدند. در دو واریته Melyanopus 26 و Melyanopus 69، گیاهان کلاس 5 تنوع در تعداد کاریوپس گوش مشاهده شد (جدول 6).
در بین ارقام جدید، بیشتر گیاهان به ترتیب در کلاس های 3 و 2 - 50.5 و 24 درصد طبقه بندی شدند (جدول 6). مشخصه این است که برخی از گونه ها با وجود تعداد بیشتری نسبت به میانگین تعداد گیاهان کلاس مربوطه مشخص می شوند: تنوع طبقه 2 - Saratovskaya 59 (56%)، Elizavetinskaya (32%)، Krassar (32%)، Gordeiforme. 32 (28%)، ساراتوفسکایا طلایی (28%)؛ تغییرات طبقه 3 - والنتینا (72%)، آننوشکا (60%)، کراسار (56%)، ساراتوفسکایا 40 (52%)، نیک (52%)، الیزاوتینسکایا (52%). تغییرات کلاس 4 - Zo-
موج لوتایا (36٪)، آننوشکا (32٪)، طلایی ساراتوف و لیودمیلا (20٪). قابل ذکر است که بر خلاف سالهای گذشته، در شرایط سال 2009، برخی از گیاهان نیمی از واریته ها در رده پنجم تنوع در تعداد دانه های بلال قرار داشتند - لیودمیلا، نیک، زولوتایا ولنا، آنوشکا، ملیانوپوس 26. و Melyanopus 69 (به جدول 6 مراجعه کنید).
جدول 6. تعداد شاخه های گونه های گندم انتخابی ساراتوف بر اساس طبقات تنوع در تعداد دانه های بلال، % (2009)
کلاس تنوع تنوع
1 2 3 4 5
Gordeiforme 432 12 28 28 32 0
ملانوپوس 26 8 22 46 20 4
ملانوپوس 69 12 8 44 32 4
ساراتوفسکایا 40 4 20 52 24 0
قدیمی 9 19.5 42.5 27 2
ساراتوفسکایا 59 12 56 24 8 0
ساراتوف طلایی 4 28 48 20 0
لیودمیلا 0 12 52 20 16
والنتینا 4 20 72 4 0
نیک 8 24 52 8 8
Elizavetinskaya 4 32 52 12 0
موج طلایی 4 12 40 36 8
آنوشکا 4 0 60 32 4
کراسر 12 32 56 0 0
جدید 6 24 50.5 15.5 4
بررسیهای انجامشده نشان داد که شرایط فصل رشد بهطور معنیداری بر توزیع گیاهان در جمعیت کشاورزی با توجه به طبقات تنوع در تعداد دانههای بلال تأثیر میگذارد. در میان انواع انتخاب ساراتوف در شرایط شدید شرایط اقلیمی سال، تعداد بیشتری از گیاهان مشخص است: گونه های باستانی - کلاس 1، گونه های جدید - کلاس های 1، 2 و 3، و برخی از آنها دارای تغییرات کلاس 4 هستند. در شرایط اقلیمی مساعد کشاورزی، تعداد گیاهان طبقه بندی شده به عنوان طبقات بالاتر از تنوع در تعداد دانه در سنبله های گندم دوروم افزایش می یابد.
در شرایط فصل رشد سال 2007، تعداد شاخههای اصلی واریتههای گندم انتخابی ساراتوف بر اساس توده کاریوپس بلال در کلاسهای 1 و 2 تنوع قرار داشت (جدول 7).
هنگام تجزیه و تحلیل واریته ها بر اساس گروه، مشخص شد که برای برخی از نژادهای بومی، تعداد گیاهان از تنوع کلاس 1 بود.
100٪ - Gordeiforme 432 و Melyanopus 26.93٪ - Saratovskaya 40. نژاد بومی Melyanopus 69 از این نظر به طور قابل توجهی متفاوت بود که با تعداد بیشتری از گیاهان کلاس 2 مشخص می شود - 80%. برای گروه گونه های جدید، مشخص شد که برخی از گونه ها با تعداد بیشتری از گیاهان کلاس مربوطه نسبت به میانگین مشخص می شوند: کلاس 1 - Zolotaya Volna (96٪)، Saratovskaya 59 (80٪)، کراسار (76). ٪، آنوشکا (68٪)؛ کلاس دوم - نیک (52%)، لیودمیلا (48%)، ساراتوف طلایی (44%)، والنتینا و الیزوتینسکایا (40%)؛ تغییرات کلاس 3 - لیودمیلا (28٪)، ساراتوف طلایی (24٪)، نیک (14٪)، والنتینا - 12٪. قابل توجه است که در دو واریته، لیودمیلا و والنتینا، گیاهان کلاس 5 تنوع در جرم کاریوپس گوش مشاهده شد - به ترتیب 12 و 4٪ (جدول 7 را ببینید).
جدول 7. تعداد شاخه های رقم گندم انتخابی ساراتوف بر اساس طبقات تنوع وزنی دانه، % (2007)
کلاس تنوع تنوع
1 2 3 4 5
Gordeiforme 432 100 0 0 0 0
ملانوپوس 26 100 0 0 0 0
ملانوپوس 69 4 80 16 0 0
ساراتوفسکایا 40 93 7 0 0 0
قدیمی 74 22 4 0 0
ساراتوفسکایا 59 80 16 4 0 0
ساراتوف طلایی 32 44 24 0 0
لیودمیلا 12 48 28 12 0
والنتینا 44 40 12 4 0
نیک 28 52 14 6 0
Elizavetinskaya 56 40 4 0 0
موج طلایی 96 4 0 0 0
آنوشکا 68 32 0 0 0
کراسر 76 20 4 0 0
جدید 55 33 9.5 2.5 0
تحت شرایط فصل رشد سال 2008، تعداد متفاوتی از گیاهان از کلاس مربوطه از تنوع در توده کاریوپس گوش مشاهده شد. در میان گونه های باستانی انتخاب ساراتوف، تعداد بیشتری از گیاهان برای این عنصر بهره وری مطابق با طبقه دوم تنوع - 48٪، در میان گونه های جدید - به کلاس های 3 و 2 تنوع - به ترتیب 38 و 36٪ است. تعداد معینی از گیاهان از واریته های مربوطه در کلاس های 4 و 5 تنوع توزیع شده اند (جدول 8).
کلاس تنوع تنوع
1 2 3 4 5
Gordeiforme 432 12 48 32 4 4
ملانوپوس 26 0 32 44 12 12
ملانوپوس 69 16 60 20 4 0
ساراتوفسکایا 40 24 52 12 8 4
قدیمی 13 48 27 7 5
ساراتوفسکایا 59 48 48 4 0 0
ساراتوف طلایی 4 24 64 4 4
لیودمیلا 12 48 28 12 0
والنتینا 4 36 56 0 4
نیک 12 44 32 12 0
Elizavetinskaya 8 36 36 20 0
موج طلایی 8 28 40 20 4
آنوشکا 8 36 36 16 4
کراسر 4 28 48 20 0
جدید 12 36 38 12 2
برخی از واریته های ساراتوف با نسبت زیادی نسبت به میانگین نمایش گیاهان از کلاس تغییرات مربوطه در توده کاریوپس گوش متمایز شدند: کلاس 1 - Saratovskaya 59 (48٪)، Saratovskaya 40 (24٪)، Melyanopus 69 (16٪). ) طبقه 2 - Melyanopus 69 (60%)، Saratovskaya 40 (52%)، Saratovskaya 59 و Lyudmila (به ترتیب 48٪)، نیک (44%). کلاس 3 - ساراتوف طلایی (64%)، والنتینا (56%)، کراسار (48%)، ملیانوپوس 26 (44%)؛ کلاس 4 - الیزابت، موج طلایی و کراسار (به ترتیب 20٪)؛ تنوع کلاس پنجم - ملانوپوس 26 - 12٪ (جدول 8 را ببینید).
در شرایط فصل رشد 2009، اکثر گیاهان گندم از ارقام انتخابی ساراتوف بر اساس وزن دانههای بلال به کلاسهای 3 و 4 تنوع اختصاص یافتند. علاوه بر این، مقادیر متوسط کلاس های تنوع گروه گونه های باستانی و گروه گونه های جدید به طور قابل توجهی متفاوت بود. به ویژه، گونه های باستانی با نمایش وسیعی از گیاهان کلاس های تنوع 3 و 4 متمایز شدند - به ترتیب 41.5 و 29.5٪، واریته های جدید با حضور غالب گیاهان کلاس های 4 و 3 تنوع در جمعیت کشاورزی متمایز شدند. - به ترتیب 44 و 26 درصد. قابل توجه تعداد قابل توجهی از گیاهان کلاس 5 تنوع در توده کاریوپس گوش است که به ویژه برای انواع کراسار (32٪)، والنتینا (24٪)، زولوتایا ولنا (20٪)، Saratovskaya 40-16 مشخص است. % (جدول 9).
کلاس تنوع تنوع
1 2 3 4 5
Gordeiforme 432 4 16 48 32 0
ملانوپوس 26 4 28 38 18 12
ملانوپوس 69 0 8 48 40 4
ساراتوفسکایا 40 4 20 32 28 16
قدیمی 3 18 41.5 29.5 8
ساراتوفسکایا 59 14 36 38 8 4
ساراتوف طلایی 4 8 28 52 8
لیودمیلا 0 0 12 80 8
والنتینا 0 8 28 40 24
نیک 8 20 28 36 8
Elizavetinskaya 0 20 24 44 12
موج طلایی 0 16 32 32 20
آنوشکا 4 8 32 56 0
کراسر 0 8 12 48 32
جدید 3 14 26 44 13
مانند سال های دیگر، برخی از گونه ها با نسبت زیادی نسبت به میانگین نمایندگی گیاهان از کلاس مربوطه از تنوع در توده دانه های بلال متمایز شدند: کلاس 1 - Saratovskaya 59 (14٪). کلاس 2 - ساراتوفسکایا 59 (36%)، ملیانوپوس 26 (28%)، ساراتوفسکایا 40، نیک و الیزاوتینسکایا (به ترتیب 20%)؛ تغییرات کلاس 3 - Gordeiforme 432 و Melyanopus 69 (به ترتیب 48٪)، Saratovskaya 59 (38٪)، موج طلایی و آننوشکا (به ترتیب 32٪). تغییرات کلاس 4 - لیودمیلا (80٪)، آننوشکا (56٪)، طلایی ساراتوف (52٪)، کراسار (48٪)، Melyanopus 69-40٪ (جدول 9 را ببینید).
بنابراین، بررسیهای انجامشده نشان داد که توزیع گیاهان در جمعیت کشاورزی بر اساس طبقات تنوع توده کاریوپسهای گوش بهطور معنیداری تحت تأثیر شرایط فصل رشد است. برای اکثر نژادهای بومی، در شرایط رشد شدید، تعداد گیاهان کلاس 1 93-100٪ است، در حالی که گونه های جدید با نمایش قابل توجهی از گیاهان کلاس 2 و 3 متمایز می شوند. در شرایط رشد مطلوب، نسبت گیاهان با کلاس تنوع بالاتر افزایش مییابد، اما برای گونههای جدید همین روند باقی میماند - تعداد بیشتری از گیاهان با کلاسهای بالاتر تنوع در توده کاریوپس گوش در مقایسه با گونههای باستانی.
Morozova Z. A. تجزیه و تحلیل مورفوژنتیک در اصلاح گندم. M.: MGU، 1983. 77 ص.
Morozova Z. A. الگوهای اساسی مورفوژنز گندم و اهمیت آنها برای انتخاب. M.: MGU، 1986. 164 ص.
Morozova Z. A. جنبه مورفوژنتیک مشکل بهره وری گندم // مورفوژنز و بهره وری گیاهان. M.: MSU، 1994. ص 33-55.
Rostovtseva Z. P. تأثیر پاسخ دوره نوری گیاه بر عملکرد مریستم آپیکال در اندامزایی رویشی و زایشی // مورفوژنز نور و گیاه. م.، 1978. ص 85-113.
Rostovtseva Z. P. رشد و تمایز اندام های گیاهی. M.: MGU 1984. 152 ص.
Stepanov S. A.، Mostovaya L. A. ارزیابی بهره وری انواع بر اساس اندام زایی اولیه شاخه های گندم // فرآیند تولید، مدل سازی آن و کنترل مزرعه. ساراتوف: انتشارات سارات. دانشگاه، 1990. صص 151-155.
استپانوف S.A. ویژگی های مورفوژنتیک اجرای فرآیند تولید در گندم بهاره // Izv. SSU Ser.، شیمی، زیست شناسی، اکولوژی. 2009. T. 9، شماره 1. ص 50-54.
Adams M. توسعه گیاهی و بهره وری محصول // CRS Handbook Agr. بهره وری. 1982. ج.1. ص 151-183.
UDC 633.11: 581.19
یو. وی. دشتویان، اس. ا. استپانوف، م. یو. کاساتکین
ساراتوفسکی دانشگاه دولتیآنها N. G. Chernyshevsky 410012, Saratov, st. Astrakhanskaya، 83 ایمیل: [ایمیل محافظت شده]
ویژگیهای محتوای رنگدانههای گروههای مختلف (کلروفیلهای a و b، کاروتنوئیدها) و همچنین روابط بین آنها در برگهای گندم متعلق به فیتومرهای شاخههای مختلف مشخص شده است. حداقل یا حداکثر مقدار کلروفیل و کاروتنوئید را می توان در برگ های مختلف مشاهده کرد که بستگی به شرایط رشد گیاه دارد.
کلمات کلیدی: فیتومر، کلروفیل، کاروتنوئید، برگ، گندم.
ساختار و حفظ رنگدانه های فتوسنتز در صفحه برگ گندم
ی. و. دشتجان، اس. ا. استپانوف، م. ی. کاساتکین
ویژگی های نگهداری رنگدانه های گروه های مختلف (کلروفیل a و کلروفیل b، کاروتنوئیدها) و همچنین برابری بین آنها در برگ گندم